Карбонат калия
карбонат калия
| карбонат калия | |
|---|---|
 |
|
 |
|
| Систематическое наименование |
карбонат калия |
| Традиционные названия | поташ |
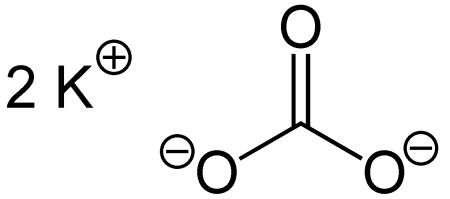
| Хим. формула | CK₂O₃ |
| Состояние | кристаллическое |
| Молярная масса | 138,205 г/моль |
| Плотность | 2,44 г/см³ |
| Т. плав. | 891 °C |
| Растворимость в воде | 110,5 г/100мл (20 °C) |
| ГОСТ | ГОСТ 4221-76 ГОСТ 10690-73 |
| Рег. номер CAS | 584-08-7 |
| PubChem | 11430 |
| Рег. номер EINECS | 209-529-3 |
| SMILES |
C(=O)([O-])[O-].[K+].[K+]
|
| InChI |
1S/CH2O3.2K/c2-1(3)4;;/h(H2,2,3,4);;/q;2*+1/p-2
BWHMMNNQKKPAPP-UHFFFAOYSA-L
|
| Кодекс Алиментариус | E501(i) |
| RTECS | TS7750000 |
| ChEBI | 131526 |
| ChemSpider | 10949 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
карбонат калия, углекислый калий, арх. поташ K2CO3 — средняя соль калия и угольной кислоты. Это белое кристаллическое вещество, хорошо растворимое в воде. Малотоксичен, относится к III классу опасности.
Старое название соли — поташ из нидерл. рotasсh напрямую или через нем. Pottasche, фр. potasse.
Содержание
История

поташ — одна из солей, известных людям ещё в древности. Обычно поташ загрязнён различными примесями, поэтому не имеет такого чисто-белого цвета, как измельчённый карбонат калия. До XX века в Европе поташ был одним из важнейших промышленных химических реагентов. Его получали путём водной экстракции из растительной золы, с дальнейшей очисткой до необходимого уровня. Производство было сосредоточено в местах, богатых лесом — кое-где в Европе, но, в основном, в России и Северной Америке, — то есть именно там, где за несколько тысяч лет до н. э. находились языки отходящих в сторону северного полюса вместе с глобальным потеплением ледников (как правило, в тех местностях, где Вода предельно жёсткая).
На производство поташа ещё Петр I в 1721 году установил монополию: «Нигде никому отнюдь поташа не делать и никому не продавать под страхом ссылки в вечную каторжную работу». С целью сбережения леса, поскольку вводил технологию производства поташа из «худых бочек, сучьев и прочих обрезков» то есть вторичная переработка.
Физические и химические свойства
Выглядит как бесцветные или белые кристаллы, имеющие моноклинную сингонию, переходит в гексагональную при 420 °C. Плотность моноклинной модификации 2,44 г/см3, гексагональной 2,27 г/см3. Температура плавления — 891 °C. Растворим в воде: 105,5/100 мл (0 °C), 110,5 (20 °C), 155,7 (100 °C). Гигроскопичен.
Образует несколько различных гидратов с 5, 1,5 и 0,5 молекулами воды, гидрат с 1,5·H2O образуется при кристаллизации из водных растворов и хранении безводной формы на воздухе. Все перечисленные гидраты полностью обезвоживаются при 150—160 °C.
Водные растворы карбоната калия присоединяют углекислый газ с образованием гидрокарбоната калия. С двуокисью серы водные растворы реагируют с образованием гидросульфита калия и двуокиси углерода.
Получение
карбонат калия получают:
- как побочный продукт получается при переработке нефелинов.
- путём электролиза хлорида калия, в результате чего образуется гидроксид калия, который, вступая в реакцию с углекислым газом, образует воду и карбонат калия:
- 2KOH + CO2 → K2CO3 + H2O
- воздействием CO2 на раствор гидроксида калия.
Для использования в качестве удобрения, поташ получают из щёлока при выщелачивании водой золы из злаков или водорослей, так как именно карбоната калия больше всего в растворимой части растительных остатков (белая «зола» от костра — в основном поташ). Принцип добычи: в глиняный обожжённый сосуд с небольшим отверстием на дне насыпали золу и слегка утрамбовывали. Потом его заливали определённым количеством воды. Воду, прошедшую через сосуд, тщательно собирали и ею заливали следующую партию. И так до тех пор, пока жидкость не приобретала сиропообразную консистенцию. После лишнюю жидкость выпаривали в металлической посуде и получали поташ.
Применение
карбонат калия применяют:
- для изготовления жидкого мыла;
- для производства пигментов;
- для производства хрустального, оптического или тугоплавкого стекла;
- крашения;
- для выращивания сельскохозяйственных культур (соли калия являются хорошим удобрением для растений);
- в фотографии как элемент проявителей;
- в качестве добавки в строительный раствор и бетон для уменьшения температуры замерзания (даёт белые пятна, поэтому разрабатываются специальные противоморозные присадки, не дающие разводов);
- для производства других соединений калия;
- как поглотитель сероводорода при очистке газов;
- как обезвоживающий агент;
- зарегистрирован в качестве пищевой добавки E501.


