Сульфид калия
Сульфид калия
| Сульфид калия | |
|---|---|
 |
|
| Систематическое наименование |
калия сульфид |
| Традиционные названия | Калий сернистый, Сульфид калия, калия моносульфид |
| Хим. формула | K2S |
| Состояние | бесцветный порошок с запахом тухлых яиц |
| Молярная масса | 110,262 г/моль |
| Плотность | 1,805 г/см³ |
| Температура | |
| • плавления | 471; 948 °C |
| Мол. теплоёмк. | 76,15 Дж/(моль·К) |
| Энтальпия | |
| • образования | −387,3 кДж/моль |
| Растворимость | |
| • в воде | растворяется с образованием KSH, KOH |
| • в остальных веществах | растворяется в этаноле и глицерине |
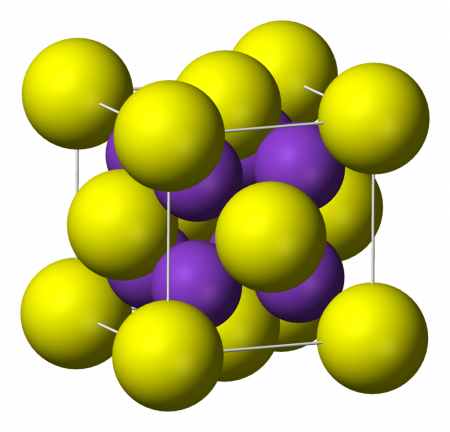
| Кристаллическая структура | кубическая сингония |
| Рег. номер CAS | 1312-73-8 |
| PubChem | 14800 |
| Рег. номер EINECS | 215-197-0 |
| SMILES |
[SH-].[K+].[K+]
|
| InChI |
1S/2K.H2S/h;;1H2/q2*+1;/p-1
FANSKVBLGRZAQA-UHFFFAOYSA-M
|
| RTECS | TT6000000 |
| ChemSpider | 14116 |
| Пиктограммы ECB |   |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Калия сульфид — бинарное неорганическое химическое соединение калия с серой. Представляет собой соединение с формулой K2S.
Содержание
Физические свойства
Сульфид калия K2S — бесцветные кубические кристаллы (a = 0,739 нм, Z=4; пространственная группа Fm3m). Хорошо растворимы в воде (с гидролизом). Растворим в спирте и глицерине. Гигроскопичен, образует ди- и пентагидраты.
Получение
Прямой синтез из элементов:
- 2K + S →100−200oC K2S
Восстановление сульфата калия водородом:
- K2SO4 + 4H2 →600oC,Fe2O3 K2S + 4H2O
или углеродом (в промышленности — кокс):
- K2SO4 + 4C →900oC K2S + 4CO
Сульфит калия при нагревании диспропорционирует:
- 4K2SO3 →600oC K2S + 3K2SO4
Химические свойства
На воздухе медленно окисляется:
- 2K2S + 2O2 + H2O ⟶ K2S2O3 + 2KOH
в зависимости от условий проведения этой реакции образуются побочные продукты: коллоидная сера, Полисульфиды калия.
Сульфид калия при поджигании сгорает:
- 2K2S + 2O2 →>500oC K2SO4
Так как сероводород является слабой кислотой, то Сульфид калия разлагается кислотами:
- K2S + 2HCl ⟶ 2KCl + H2S↑
Концентрированные кислоты могут окислять выделяемый сероводород:
- K2S + 3H2SO4 ⟶ 2KHSO4 + SO2↑ + S↓ + 2H2O
При кипячении раствора сульфида калия с серой или сплавления его с серой образуются полисульфиды:
- K2S + (n − 1)S → K2Sn
для калия выделены полисульфиды вплоть до n = 6.
При пропускании через раствор сульфида калия избытка сероводорода образуются Гидросульфид калия:
- K2S + H2S ⟶ 2KHS
Реагирует, образовывая соединения с сульфидами Ag, Sn и другими.
Применение
Калия сульфид компонент светочувствительных эмульсий в фотографии, аналитический реагент для разделения сульфидов металлов, является компонентом входящим в состав для удаления наружного слоя шкур.
В пиротехническом деле
Сульфид калия образуется при сжигании пороха.