Сульфат железа (III)
Сульфат железа (III)
| Сульфат железа (III) | |
|---|---|
 |
|
| Систематическое наименование |
Сульфат железа (III) |
| Традиционные названия | сернокислое железо (III), тетрасульфид (VI) железа (III) |
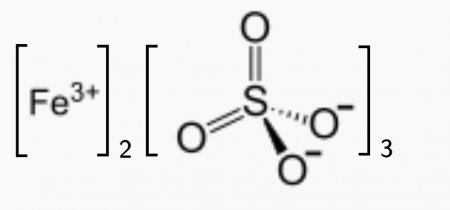
| Хим. формула | Fe2(SO4)3 |
| Рац. формула | Fe2O12S3 |
| Состояние | безводный — светло-жёлтый порошок |
| Молярная масса |
(безв.) 399.88 г/моль (пентагидрат) 489.96 г/моль |
| Плотность |
(безв.) 3.097 г/см³ (пентагидрат) 1.898 (нонагидрат) 2.1 г/см³ |
| Температура | |
| • плавления |
(безв.) 480 °C (с разл.) (нонагидрат) 175 °C |
| • разложения | 600 |
| Мол. теплоёмк. | 271,75 Дж/(моль·К) |
| Энтальпия | |
| • образования | −2580 кДж/моль |
| Растворимость | |
| • в воде | (безв.) растворим(нонагидрат) 440 г/100 мл |
| • в этаноле | (нонагидрат) растворим |
| Рег. номер CAS |
10028-22-5 15244-10-7 (для всех гидратов с формулой Fe2(SO4)3·nH2O (где n=1, 3, 4, 6, 7, 9, 10, 12) |
| PubChem | 24826 |
| Рег. номер EINECS | 233-072-9 |
| SMILES |
[O-]S(=O)(=O)[O-].[O-]S(=O)(=O)[O-].[O-]S(=O)(=O)[O-].[Fe+3].[Fe+3]
|
| InChI |
1S/2Fe.3H2O4S/c;;3*1-5(2,3)4/h;;3*(H2,1,2,3,4)/q2*+3;;;/p-6
RUTXIHLAWFEWGM-UHFFFAOYSA-H
|
| RTECS | NO8505000 |
| ChEBI | 53438 |
| ChemSpider | 23211 и 21493902 |
| ЛД50 | (крысы, орально) 500 мг/кг |
| Пиктограммы ECB |  |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Сульфат железа (III) (лат. Ferrum sulfuricum oxydatum) — неорганическое химическое соединение, соль, химическая формула—Fe2(SO4)3.
Содержание
Физические свойства
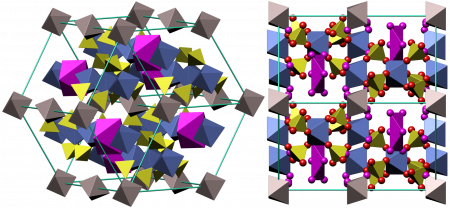
Безводный Сульфат железа (III) — светло-жёлтые парамагнитные очень гигроскопичные кристаллы моноклинной сингонии, пространственная группа P21/m, параметры элементарной ячейки a = 0,8296 нм, b = 0,8515 нм, c = 1,160 нм, β = 90,5°, Z = 4. Есть данные, что безводный Сульфат железа образовывает орторомбическую и гексагональную модификации. Растворим в воде, трудно растворим в этаноле.
Из воды кристаллизуется в виде кристаллогидратов Fe2(SO4)3·n H2O, где n = 12, 10, 9, 7, 6, 4, 3, 1. Наиболее изученный кристаллогидрат — нонагидрат сульфата железа (III) Fe2(SO4)3·9H2O — жёлтые гексагональные кристаллы, параметры элементарной ячейки a = 1,085 нм, c = 1,703 нм, Z = 4. Хорошо растворяется в воде (440 г на 100 г воды). В водных растворах Сульфат железа(III) из-за гидролиза приобретает красно-коричневый цвет.
При нагревании нонагидрат превращается при 98 °C в тетрагидрат, при 125 °C — в моногидрат и при 175 °C — в безводный Fe2(SO4)3, который выше 600 °C разлагается на Fe2O3 и SO3.
Нахождение в природе
Минералогическая форма сульфата железа (III) — микасаит (англ. mikasaite), смешанный Сульфат железа-алюминия. Его химическая формула — (Fe3+, Al3+)2(SO4)3. Этот минерал содержит безводную форму сульфата железа, поэтому встречается в природе очень редко. Гидратированные формы встречаются чаще, например:
- Кокимбит (англ. coquimbite) — Fe2(SO4)3·9H2O — нонагидрат — наиболее распространённая в природе форма.
- Паракокимбит (англ. paracoquimbite) — другой нонагидрат — редкая форма.
- Корнелит (англ. kornelite) — гептагидрат — и куэнстедтит (англ. quenstedtite) — декагидрат — тоже встречаются редко.
- Лаусенит (англ. lausenite) — гекса- или пентагидрат (самостоятельность этого минерала под вопросом).
Все перечисленные выше природные гидраты железа на поверхности Земли нестабильны. Но их запасы постоянно пополняются благодаря окислению других минералов (в основном пирита и марказита).
Марс
Сульфат железа и ярозит были обнаружены двумя марсоходами: «Спирит» и «Оппортьюнити». Эти вещества являются признаком сильных окислительных условий на поверхности Марса. В мае 2009 года «Спирит» застрял, когда ехал по мягкому грунту планеты и наехал на залежи сульфата железа, скрытые под слоем обычного грунта. Вследствие того, что Сульфат железа имеет очень низкую плотность, марсоход застрял настолько глубоко, что часть его корпуса коснулась поверхности планеты.
Получение
В промышленности Сульфат железа (III) получают прокаливанием пирита или марказита с NaCl на воздухе:
- 2FeS2 + 2NaCl + 8O2 ⟶ Fe2(SO4)3 + Na2SO4 + Cl2
или растворяют Оксид железа (III) в серной кислоте:
- Fe2O3 + 3H2SO4 ⟶ Fe2(SO4)3 + 3H2O
В лабораторной практике Сульфат железа (III) можно получить из гидроокиси железа (III):
- 2Fe(OH)3 + 3H2SO4 ⟶ Fe2(SO4)3 + 6H2O
Препарат той же чистоты можно получить окислением сульфата железа (II) азотной кислотой:
- 2FeSO4 + H2SO4 + 2 HNO3 ⟶ Fe2(SO4)3 + 2NO2 + 2H2O
также окисление можно провести кислородом или оксидом серы:
- 12FeSO4 + 3O2 ⟶ 4Fe2(SO4)3 + 2Fe2O3
- 2FeSO4 + 2SO3 ⟶ Fe2(SO4)3 + SO2
Концентрированные серная и азотная кислоты окисляют сульфид железа до сульфата железа (III):
- 2FeS + H2SO4 + 18HNO3 ⟶ Fe2(SO4)3 + 18NO2↑ + 10H2O
Дисульфид железа можно окислить концентрированной серной кислотой:
- 2FeS2 + 14H2SO4 ⟶ Fe2(SO4)3 + 15SO2↑ + 14H2O
Сульфат-аммоний железа (II) (Соль Мора) также можно окислить дихроматом калия. Вследствие данной реакции выделятся сразу четыре сульфата — железа (III), хрома (III), аммония и калия, и Вода:
- 6Fe(NH4)2(SO4)2 + 7H2SO4 + K2Cr2O7 ⟶ Fe2(SO4)3 + Cr2(SO4)3 + 6(NH4)2SO4 + K2SO4 + 7H2O
Сульфат железа (III) можно получить как один из продуктов термического разложения сульфата железа (II):
- 6FeSO4 →T Fe2(SO4)3 + 2Fe2O3 + 3SO2
Ферраты с разбавленной серной кислотой восстанавливаются до сульфата железа (III):
- 4K2FeO4 + 10H2SO4 → 2Fe2(SO4)3 + 3O2↑ + 4K2SO4 + 10H2O
При нагревании пентагидрата до температуры 70—175 °C получается безводный Сульфат железа (III):
- Fe2(SO4)3 ⋅ 5H2O →70−175oC Fe2(SO4)3 + 5H2O
Сульфат железа (II) можно окислить триоксидом ксенона:
- XeO3 + 3H2SO4 + 6FeSO4 ⟶ 3Fe2(SO4)3 + Xe↑ + 3H2O
Химические свойства
Сульфат железа (III) в водных растворах подвергается сильному гидролизу по катиону, при этом раствор окрашивается в красновато-коричневый цвет:
- Fe[(H2O)6]3+ + H2O ⇄ Fe[(H2O)5(OH)]2+ + H3O+ ; pK = 2,17
- Fe[(H2O)5(OH)]2+ + H2O ⇄ Fe[(H2O)4(OH)2]+ + H3O+ ; pK = 3,26
- [2Fe(H2O)6]3+ + 2H2O ⇄ [Fe2(H2O)8(OH)2]4+ + 2H3O+ ; pK = 2,91
Горячая Вода или пар разлагают Сульфат железа (III):
- Fe2(SO4)3 + 2H2O →100oC 2FeSO4(OH)↓ + H2SO4
Безводный Сульфат железа (III) при нагревании разлагается:
- Fe2(SO4)3 →500−700oC Fe2O3 + 3SO3
- 2Fe2(SO4)3 →900−1000oC 2Fe2O3 + 6SO2 + 3O2
Растворы щелочей разлагают Сульфат железа (III), продукты реакции зависят от концентрации щёлочи:
- Fe2(SO4)3 + 2NaOH ⟶ 2FeSO4(OH)↓ + Na2SO4
- Fe2(SO4)3 + 6NaOH ⟶ 2FeO(OH)↓ + 3Na2SO4 + 2H2O
Если с щёлочью взаимодействует эквимолярный раствор сульфатов железа (III) и железа (II), то в результате получится сложный Оксид железа:
- Fe2(SO4)3 + FeSO4 + 8NaOH ⟶ Fe3O4↓ + 4Na2SO4 + 4H2O
Активные металлы (такие как магний, цинк, кадмий, железо) восстанавливают Сульфат железа (III):
- Fe2(SO4)3 + Fe ⟶ 3FeSO4
Некоторые сульфиды металлов (например, меди, кальция, олова, свинца, ртути) в водном растворе восстанавливают Сульфат железа (III):
- CuS + Fe2(SO4)3 ⟶ 2FeSO4 + CuSO4 + S
С растворимыми солями ортофосфорной кислоты образует нерастворимый фосфат железа (III) (гетерозит):
- Fe2(SO4)3 + 2NaH2PO4 ⟶ Na2SO4 + 2H2SO4 + 2FePO4↓
Использование
- Как реактив при гидрометаллургической переработке медных руд.
- Как коагулянт при очистке сточных вод, коммунальных и промышленных стоков.
- Как протрава при окраске тканей.
- При дублении кожи.
- Для декапирования нержавеющих аустенитных сталей, сплавов золота с алюминием.
- Как флотационный регулятор для уменьшения плавучести руд.
- В медицине используется в качестве вяжущего и кровоостанавливающего средства.
- В химической промышленности как окислитель и катализатор.