Хлорат калия
Хлорат калия
| Хлорат калия | |
|---|---|
 |
|
 |
|
| Систематическое наименование |
Хлорат калия |
| Традиционные названия | Бертолетова соль |
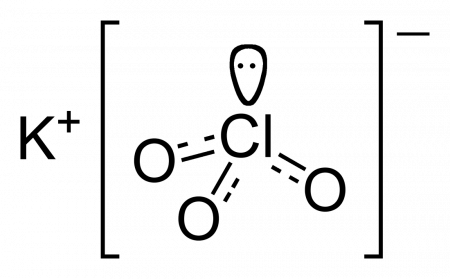
| Хим. формула | KClO3 |
| Состояние | Бесцветные кристаллы |
| Молярная масса | 122.55 г/моль |
| Плотность | 2,32 г/см³ |
| Температура | |
| • плавления | 356 °C |
| • разложения | ~ 400 |
| Энтальпия | |
| • образования | -391,204 кДж/моль |
| Растворимость | |
| • в воде при 0°C | 3,25 г/100 мл |
| • в воде при 20°C | 7,3 г/100 мл |
| • в воде при 100°C | 56,2 г/100 мл |
| • в воде при 104,2°C | 61,5 г/100 мл |
| Рег. номер CAS | [3811-04-9] |
| PubChem | 6426889 |
| Рег. номер EINECS | 223-289-7 |
| SMILES |
[O-]Cl(=O)=O.[K+]
|
| InChI |
1S/ClHO3.K/c2-1(3)4;/h(H,2,3,4);/q;+1/p-1
VKJKEPKFPUWCAS-UHFFFAOYSA-M
|
| RTECS | FO0350000 |
| Номер ООН | 1485 |
| ChemSpider | 18512 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Хлорат калия (Бертолетова соль, Калий хлорноватокислый) — калиевая соль хлорноватой кислоты.
Содержание
- 1 История
- 2 Получение
- 3 Химические свойства
- 4 Применение
- 5 Токсичность

История
Впервые получен Клодом Бертолле (отсюда название бертолетова либо бертоллетова соль) в 1786 году при пропускании хлора через горячий концентрированный раствор гидроксида калия:
-
- 6KOH + 3Cl2 → KClO3 + 5KCl + 3H2O
![Хлорат калия]()
Получение
Промышленное получение хлоратов вообще (и хлората калия в частности) основано на реакции диспропорционирования гипохлоритов, в свою очередь получаемых взаимодействием хлора с растворами щелочей:
-
- Cl2 + 2OH− → ClO− + Cl− + H2O
-
- 3ClO− → ClO3− + 2Cl−
Технологическое оформление процесса может быть различно: поскольку наиболее многотоннажным продуктом является гипохлорит кальция (входящий в состав хлорной извести), то наиболее распространённым процессом является проведение реакции обмена между хлоратом кальция (получающимся из гипохлорита кальция при нагреве) и хлоридом калия, который, в силу относительно низкой растворимости, кристаллизуется из маточного раствора.
Также Хлорат калия получают модифицированным методом Бертолле при бездиафрагменном электролизе хлорида калия, образующийся при электролизе хлор вступает во взаимодействие in situ (в момент выделения, «на месте») с гидроксидом калия с образованием гипохлорита калия, который далее диспропорционирует на Хлорат калия и исходный Хлорид калия. При использовании графитовых анодов более удобным методом является электролиз хлорида натрия с получением хлората натрия и обменная реакция с хлоридом калия. Это позволяет очищать от анодного шлама раствор хлората натрия, который имеет значительно большую растворимость, чем Хлорат калия, и, таким образом, удобнее для фильтрации.
Химические свойства
- При температуре ~ 400 °C разлагается с выделением кислорода с промежуточным образованием перхлората калия:
-
- 4KClO3 →400oC 3KClO4 + KCl
- В присутствии катализаторов (MnO2, Fe2O3, CuO и др.) температура разложения значительно снижается (до ~ 200 °C).
-
- 2KClO3 →150−300 2KCl + 3O2
- Реагирует с сульфатом аммония в водно-спиртовом растворе c образованием хлората аммония:
-
- (NH4)2SO4 + 2KClO3 → 2NH4ClO3 + K2SO4
![Хлорат калия]()
Применение
Взрывчатые вещества
Смеси хлората калия с восстановителями (фосфором, серой, алюминием, органическими соединениями) взрывчаты и чувствительны к трению и ударам, чувствительность повышается в присутствии броматов и солей аммония.
Из-за высокой чувствительности составов с бертолетовой солью, они практически не применяются для производства промышленных и военных взрывчатых веществ.
Иногда используется в пиротехнике как источник хлора для цветнопламенных составов, входит в состав горючего вещества спичечной головки, и крайне редко в качестве инициирующих взрывчатых веществ (хлоратный порох — «сосис», детонирующий шнур, тёрочный состав ручных гранат вермахта).
В медицине
Некоторое время растворы хлората калия применялись в качестве слабого антисептика, наружного лекарственного средства для полоскания горла.
Для получения кислорода
В начале XX века использовалась для лабораторного получения кислорода, но из-за малой доступности его перестали применять.

Для получения диоксида хлора
Реакция восстановления хлората калия щавелевой кислотой при добавлении серной кислоты используется для получения диоксида хлора в лабораторных условиях:
-
- 2KClO3 + H2C2O4 + H2SO4 → K2SO4 + 2ClO2 + 2CO2 + 2H2O
Хлорат калия может реагировать со щавелевой кислотой без присутствия серной кислоты, но эта реакция не применяется для препаративного получения диоксида хлора:
-
- 2KClO3 + H2C2O4 → K2CO3 + CO2 + 2ClO2 + H2O
Токсичность
Токсичен. Смертельная доза хлората калия составляет 1 г/кг.




