Сульфат калия
Сульфат калия
| Сульфат калия | |
|---|---|
 |
|
 |
|
| Систематическое наименование |
Сульфат калия |
| Традиционные названия | сернокислый калий |
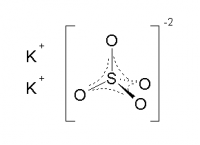
| Хим. формула | K2SO4 |
| Состояние | белое кристаллическое вещество |
| Молярная масса | 174.259 г/моль |
| Плотность | 2.66 г/см³ |
| Т. плав. | 1069 °C |
| Т. кип. | 1689 °C |
| Т. всп. | негорюч °C |
| Мол. теплоёмк. | 131,4 Дж/(моль·К) |
| Энтальпия образования | −1437,7 кДж/моль |
| Растворимость в воде |
(20 °C) 11.1 г/100 мл (25 °C) 12 г/100 мл (100 °C) 24 г/100 мл |
| Растворимость в остальных веществах | слабо растворим в глицерине, нерастворим в ацетоне, спирте, CS2 |
| Кристаллическая структура | ромбическая |
| ГОСТ | ГОСТ 4568-95 ГОСТ 4145-74 |
| Рег. номер CAS | 7778-80-5 |
| PubChem | 24507 |
| Рег. номер EINECS | 231-915-5 |
| SMILES |
[O-]S(=O)(=O)[O-].[K+].[K+]
|
| InChI |
1S/2K.H2O4S/c;;1-5(2,3)4/h;;(H2,1,2,3,4)/q2*+1;/p-2
OTYBMLCTZGSZBG-UHFFFAOYSA-L
|
| Кодекс Алиментариус | E515(i) |
| RTECS | TT5900000 |
| ChEBI | 32036 |
| ChemSpider | 22915 |
| ЛД50 | 6600 мг/кг |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Сульфат калия — неорганическое соединение. Химическая формула K2SO4.
Содержание
История
Сульфат калия был известен с начала 14-го века, изучен Глаубером, Бойлом и Тахеусом. В 17 веке он был назван arcanuni или sal duplicatum — эти названия были для кислот и щелочных солей.
Нахождение в природе
В природе находится на месторождениях калийных солей. Присутствует в водах солёных озёр.
Физические свойства
Бесцветные кристаллы, ромбическая сингония (a = 0,742 нм, b = 1,001 нм, c = 0,573 нм, Z = 4, пространственная группа Pnam). При температуре выше 584 °C переходит в гексагональную модификацию (a = 0,5947 нм, c = 0,8375 нм, Z = 2, пространственная группа P63/mmc).
Хорошо растворим в воде, не подвергается гидролизу. Нерастворим в концентрированных растворах щелочей или в чистом этаноле.
Вкус горько-солёный.
Получение
Минеральные формы чистого сульфата калия относительно редки. Минерал арканит (англ. Arcanite) состоит из чистого K2SO4, представляет собой белые или прозрачные кристаллы, встречается в Калифорнии (США).
Есть много минералов, содержащих соли калия:
- Каинит — MgSO4·KCl·H2O
- Глазерит — 2K2SO4·Na2SO4
- Шёнит — K2SO4·MgSO4·6H2O
- Леонит — K2SO4·MgSO4·4H2O
- Лангбейнит — K2SO4·2MgSO4
- Полигалит — K2SO4·MgSO4·2CaSO4·2H2O
- Сингенит — K2SO4·CaSO4·H2O
Промышленные методы получения основаны на обменных реакциях KCl с различными сульфатами и в результате Сульфат калия, как правило, сильно загрязнён побочными продуктами:
- 2KCl + 2MgSO4 ⇄ K2SO4 ⋅ MgSO4 + MgCl2
- K2SO4 ⋅ MgSO4 + 2KCl ⇄ 2K2SO4 + MgCl2
- 2KCl + Na2SO4 ⇄ K2SO4+ 2NaCl
- 2KCl+ CaSO4 ⋅ 2H2O ⇄ K2SO4 + CaCl2 + 2H2O
- 2KCl + FeSO4 ⇄ K2SO4 + FeCl2
Наиболее чистый продукт получают, обрабатывая твёрдый Хлорид калия концентрированной серной кислотой:
- 2KCl + H2SO4 →>100oC K2SO4 + 2HCl↑
Прокаливанием с углём минерала лангбейнита:
- K2SO4 ⋅ 2MgSO4 + 2C →>T K2SO4 + 2Mg↓ + 2CO2↑ + 2SO2↑
В лабораторной практике применяют следующие методы:
- из оксида калия:
- K2O + H2SO4 → K2SO4 + H2O
- вытеснением из слабых или неустойчивых кислот:
- K2CO3 + H2SO4 → K2SO4 + CO2↑ + H2O
- из щёлочи и разбавленной кислоты:
- 2KOH + H2SO4 → K2SO4 + 2H2O
- из гидросульфата калия:
- окислением сульфида калия:
- K2S + 2O2 →>500oC K2SO4
- из надперекиси калия:
- 2KO2 + S →140oC K2SO4
- 2KO2 + SO2 →100oC K2SO4 + O2
Сульфат калия получается при нагреве сульфита калия до температуры в 600 °C:
- 4K2SO3 →600oC K2S + 3K2SO4
Окисление серы бихроматом калия:
- K2Cr2O7 + S →800−1000oC Cr2O3 + K2SO4
Взаимодействием сульфата аммония и гидроксид калия:
- (NH4)2SO4 + 2KOH → K2SO4 + 2NH3↑ + 2H2O

Химические свойства
Как соль двухосновной кислоты образует кислые соли:
- K2SO4 + H2SO4 ⇄ 2KHSO4
Как все сульфаты взаимодействует с растворимыми соединениями бария:
- K2SO4 + BaCl2 → 2KCl + BaSO4↓
Восстанавливается до сульфида:
- K2SO4 + 4H2 →600oC,Fe2O3 K2S + 4H2O
- K2SO4 + 4C →900oC K2S + 4CO
С оксидом серы образует пиросульфат:
- K2SO4+ SO3 → K2S2O7
Применение
Основной потребитель сульфата калия — сельское хозяйство. Сульфат калия является ценным бесхлорным удобрением. Эффективность сульфата калия лучше проявляется на бедных калием дерново-подзолистых почвах гранулометрического состава и торфяных почвах. На черноземных почвах он применяется обычно под культуры, которые усваивают много калия и натрия (сахарная свёкла, подсолнечники, плодовые, для корнеплодов, овощей). На каштановых и серозёмных почвах используют в зависимости от вида культуры, технологии выращивания и содержания калия в почве. Сульфат калия намного эффективнее влияет на величину урожая и его качество, если его применять в комплексе с азотными и фосфорными удобрениями. На кислых почвах действие сульфата калия повышается на фоне использования извести.
Калий повышает содержание сахаров и витаминов в выращиваемой продукции, а подкормки в конце августа-сентября способствуют лучшему зимованию плодово-ягодным и декоративным деревьям и кустарникам. Используется на различных почвах, под все культуры, а также для комнатного и балконного цветоводства. Сульфат калия пригоден для всех способов внесения: основного (при перекопке почвы весной или осенью) и для подкормки в течение вегетационного периода.
Применяется в первую очередь под культуры, чувствительные к хлору (картофель, табак, лён, виноград, цитрусовые и др.). Наличие в удобрении сульфат-иона положительно влияет на урожай растений семейства крестоцветных (капуста, брюква, турнепс и др.) и бобовых, потребляющих много серы.
Также Сульфат калия используется в производстве стекла, различных квасцов и других соединений калия, как флюс в металлургии. В Европейском союзе допущен в качестве использования как пищевая добавка E515.
Сведения о безопасности
Следующие действия сульфатом калия на части тела могут вызвать:
- Глаза: попадание пыли может вызвать механическое раздражение,
- Кожа: попадание на кожу может вызвать раздражение,
- Проглатывание: употребление в пищу больших количеств может вызвать раздражение желудочно-кишечного тракта,
- Вдыхание: при вдыхании может вызвать раздражение дыхательных путей,
- При хроническом употреблении сульфата калия: отравления могут возникать в редких случаях длительного воздействия.



