Железный купорос
Железный купорос ГОСТ 6981-94
| Систематическое наименование |
Железа (II) тетраоксосульфат |
|---|---|
| Традиционные названия | Железный купорос |
| Хим. формула | FeSO4 |
| Рац. формула | O4SFe |
| Состояние | кристаллическое |
| Молярная масса | 151,932 (безв.) г/моль |
| Плотность | 1,898 г/см³ |
| Твёрдость |
2
|
| Т. разл. |
выше 680 °C
|
| Мол. теплоёмк. | 100,6 Дж/(моль·К) |
| Энтальпия образования | −928,4 кДж/моль |
| Растворимость в воде | 26,3г/100 мл при 20°C, 55,3 г/100 мл при 63,7°C |
| ГОСТ | ГОСТ 6981-94 |
| Рег. номер CAS | 7720-78-7 |
| PubChem | 24393 |
| Рег. номер EINECS | 231-753-5 |
| SMILES |
S(=O)(=O)([O-])[O-].[Fe+2]
|
| InChI |
1S/Fe.H2O4S/c;1-5(2,3)4/h;(H2,1,2,3,4)/q+2;/p-2
BAUYGSIQEAFULO-UHFFFAOYSA-L
|
| RTECS | NO8500000 |
| ChEBI | 75832 |
| ChemSpider | 22804 |
| ЛД50 | 237 мг/кг |
| Токсичность | среднетоксичен |
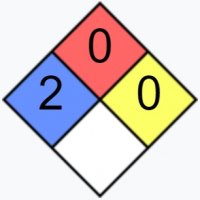
| NFPA 704 | |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Железный купорос, Сульфат железа (II), железо (II) сернокислое — неорганическое соединение, железная соль серной кислоты с формулой FeSO4. Нелетуч, не имеет запаха. Безводное вещество бесцветное, непрозрачное, очень гигроскопичное. Кристаллогидраты — гигроскопичные прозрачные кристаллы светлого голубовато-зелёного, тетрагидрат FeSO4·4H2O зелёного цвета (розенит), моногидрат FeSO4·H2O бесцветный (смольнокит). Вкус сильно-вяжущий железистый (металлический). На воздухе постепенно выветриваются (теряют кристаллизационную воду). Сульфат железа(II) хорошо растворим в воде (26,3 г при 20 °С). Из водных растворов кристаллизуется голубовато-зелёный гептагидрат FeSO4·7H2O, который носит тривиальное название Железный купорос. Токсичность железного купороса сравнительно низкая.
Применяется в текстильной промышленности, в сельском хозяйстве как фунгицид, для приготовления минеральных красок.
Природный аналог — минерал мелантерит; в природе встречается в кристаллах моноклинной сингонии, зелёно-жёлтого цвета, в виде примазок или натёков.
Содержание
- 1 Свойства
- 2 Получение
- 3 Применение
Свойства
Сульфат двухвалентного железа выделяется при температурах от 1,82 °C до 56,8 °C из водных растворов в виде светло-зелёных кристаллов кристаллогидрата FeSO4·7H2O, который называется в технике железным купоросом. В 100 г воды растворяется 26,6 г безводного FeSO4 при 20 °C и 54,4 г при 56 °C.
Растворы сульфата железа(II) под действием кислорода воздуха постепенно окисляются, переходя в Сульфат железа(III):
12FeSO4 + 3O2 + 6H2O → 4Fe2(SO4)3 + 4Fe(OH)3↓
При нагревании свыше 480 °C разлагается:
2FeSO4→ Fe2O3 + SO2 + SO3
Получение
Железный купорос можно приготовить действием разбавленной серной кислоты на железный лом, обрезки кровельного железа и т. д. В промышленности его получают как побочный продукт при травлении железных листов, проволоки, удалении окалины и др. разбавленной H2SO4.
Fe + H2SO4 → FeSO4 + H2↑
Другой способ — окислительный обжиг пирита:
FeS2 + 3O2→ FeSO4 + SO2
В промышленности получают как побочный продукт производства оксида титана из ильменита.
Применение
Применяют в производстве чернил, в красильном деле (для окраски шерсти в чёрный цвет), для консервирования дерева.
В медицине используется в качестве лекарственного средства для лечения и профилактики железодефицитной анемии. В России зарегистрирован под торговыми марками «Гемофер пролонгатум», «Тардиферон», а также «Сорбифер Дурулес» и «Ферроплекс» (в двух последних в качестве антиоксиданта добавляется аскорбиновая кислота).
В сельском хозяйстве применяется для опрыскивания садовых деревьев.
Используется в ферросульфатном методе химической дозиметрии.