Оксид олова II
Оксид олова II
| Оксид олова II | |
|---|---|
 |
|
| Систематическое наименование |
оксид оловаII |
| Традиционные названия | монооксид олова; Олово окись II, олово закись, олово одноокись |
| Хим. формула | SnO |
| Состояние | чёрный порошок |
| Молярная масса | 134.71 г/моль |
| Плотность | 6.45 г/см³ |
| Температура | |
| • плавления | (при 80 кПа) 1080 °C |
| • кипения | 1425 °C |
| • разложения | 1976 ± 1 °F[1] |
| • вспышки | негорюч °C |
| Мол. теплоёмк. | 47,8 Дж/(моль·К) |
| Теплопроводность | 47,8 Вт/(м·K) |
| Энтальпия | |
| • образования | -285,98 кДж/моль |
| Давление пара | 0 ± 1 мм рт.ст.[1] |
| Растворимость | |
| • в воде | нерастворим |
| Кристаллическая структура | тетрагональная |
| Рег. номер CAS | 21651-19-4 |
| PubChem | 88989 |
| Рег. номер EINECS | 244-499-5 |
| SMILES |
O=[Sn]
|
| InChI |
1S/O.Sn
QHGNHLZPVBIIPX-UHFFFAOYSA-N
|
| RTECS | XQ3700000 |
| ChemSpider | 80298 |
| Токсичность | при вдыхании вызывает кашель |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
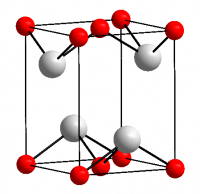
Оксид олова II — неорганическое бинарное химическое соединение олова и кислорода, химическая формула SnO, черно-синие кристаллы (по другим данным коричневато-чёрные).
Содержание
Физические свойства
Темно-синие (почти чёрные) кристаллы, тетрагональная сингония, структура типа РbО (а = 0,3802 нм, с = 0,4837 нм, Z = 2, пространственная группа P42/nmm). При давлении выше 90 ГПа (900 тыс. атм) переходит в ромбическую модификацию (а = 0,382 нм, b = 0,361 нм, с = 0,430 нм, Z = 2, пространственная группа Рm2n).
Оксид олова является полупроводником, тип проводимости которого зависит от примесей и способа получения.
Получение
Оксид олова получают осторожным разложением в инертной атмосфере гидроокиси олова:
- Sn(OH)2 →100oC,N2 SnO + H2O
Из диоксида олова:
В лабораторных условиях оксид олова часто получают осторожным нагревом оксалата олова(II) в инертной атмосфере:
- SnC2O4 →100oC, N2 SnO + CO2 + CO
С помощью твёрдотельной реакции из хлорида олова II:
Химические свойства
Оксид олова II устойчив на воздухе, амфотерен с преобладанием основных свойств. Мало растворим в воде и разбавленных растворах щелочей. Растворяется в разбавленных кислотах:
- SnO + H2SO4 → SnSO4 + H2O
и концентрированных кислотах:
Он также растворяется в сильных кислотах, давая ионные комплексы, например Sn(OH2)32+ или Sn(OH)(OH2)2+, также в менее кислотных растворах — Sn3(OH)42+.
Растворяется в концентрированных растворах щелочей и их расплавах:
Также известны другие безводные оловосодержащие соединения, например, K2Sn2O3, K2SnO2.
Диспропорционирует при нагревании:
Окисляется кислородом воздуха:
Восстанавливается до металлического олова водородом, углеродом, кремнием, бором и парами этилового спирта:
- SnO + H2 → Sn + H2O
Sn и O могут образовывать соединения нестехиометрического состава.
Применение
Оксид олова II в подавляющем большинстве случаев используется в качестве исходного продукта в производстве других, как правило, двухвалентных, соединений олова. Может применяться также в качестве восстановителя и в создании рубинового стекла. В незначительных количествах используется в качестве этерификаторного катализатора.
Оксид церия III с оксидом олова II используется в осветительных приборах как люминофор.
