Хлорид меди (I)
хлорид меди (I)
| хлорид меди (I) | |
|---|---|
 |
|
 |
|
| Систематическое наименование |
хлорид меди (I) |
| Традиционные названия | Хлористая медь |
| Хим. формула | CuCl |
| Состояние | твёрдое |
| Молярная масса | 98,999 г/моль |
| Плотность | 4,145 г/см³ |
| Температура | |
| • плавления | 426 °C |
| • кипения | 1490 °C |
| Энтальпия | |
| • образования | -136 кДж/моль |
| Растворимость | |
| • в воде | 0,0062 г/100 мл |
| Показатель преломления | 1,930 |
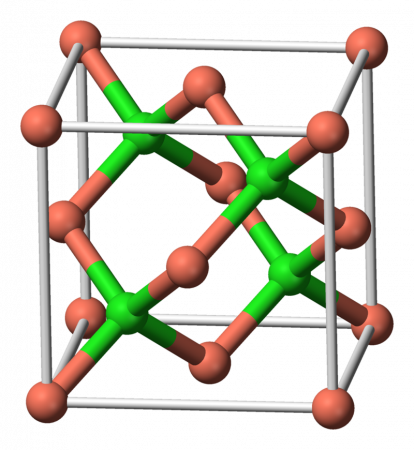
| Кристаллическая структура | Структура цинковой обманки |
| Рег. номер CAS | 7758-89-6 |
| PubChem | 62652 |
| Рег. номер EINECS | 231-842-9 |
| SMILES |
[Cu+]-[Cl-]
|
| InChI |
1S/ClH.Cu/h1H;/q;+1/p-1
OXBLHERUFWYNTN-UHFFFAOYSA-M
|
| RTECS | GL6990000 |
| ChEBI | 53472 |
| Номер ООН | 2802 |
| ChemSpider | 56403 |
| ЛД50 | 140 мг/кг |
| Пиктограммы СГС |    |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
хлорид меди (I) — бинарное химическое соединение, медная соль хлороводородной кислоты.
Представляет собой белый или зеленоватый порошок, практически нерастворимый в воде (0,0062 г/100 мл при 20 °C). Зеленоватую окраску придают примеси хлорида меди (II).
Содержание
История открытия
Впервые хлорид меди (I) был получен Робертом Бойлем в 1666 году, из хлорида ртути (II) и металлической меди:
- HgCl2 + 2Cu ⟶ 2CuCl + Hg
В 1799 году, Джозеф Луи Пруст успешно отделил дихлорид меди от монохлорида и описал эти соединения. Это было достигнуто путём нагревания CuCl2 в бескислородной среде, в результате чего хлорид меди(II) потерял половину связанного хлора. После этого он удалил остатки дихлорида меди от хлорида меди (I) и промыл водой.
- 2CuCl2 →t∘ 2CuCl + Cl2↑
Физические свойства
Монохлорид меди образует кристаллы белого цвета, кубической сингонии, пространственная группа F 43m, параметры ячейки a = 0,5418 нм, Z = 4, структура типа ZnS. При нагревании кристаллы синеют. При температуре 408 °C CuCl переходит в модификацию гексагональной сингонии, пространственная группа P 63mc, параметры ячейки a = 0,391 нм, c = 0,642 нм, Z = 4.
Монохлорид меди плавится и кипит без разложения. В пара́х молекулы полностью ассоциированы (димеры с незначительной примесью тримеров), поэтому формулу вещества иногда записывают как Cu2Cl2.
Плохо растворим в воде (0,062% при 20 °C), но хорошо в растворах хлоридов щелочных металлов и соляной кислоте. Так в насыщенном растворе NaCl растворимость CuCl составляет 8% при 40 °C и 15% при 90 °C. Водный раствор аммиака растворяет CuCl с образованием бесцветного комплексного соединения [Cu(NH3)2]Cl.
Получение
В природе монохлорид меди встречается в виде редкого минерала нантокит (по названию села Нантоко, Чили), который благодаря подмеси атакамита часто окрашен в зелёный цвет.
В промышленности монохлорид меди получают несколькими способами:
- Хлорирование избытка меди, взвешенной в расплавленном CuCl:
- 2Cu + Cl2 →450oC 2CuCl
- Восстановление CuCl2 медью в подкисленном растворе:
В лабораторной практике последний метод также широко распространён.
- Очень чистый препарат получается при взаимодействии меди с газообразным хлористым водородом:
- 2Cu + 2HCl →500−600oC 2CuCl + H2
- Похожая реакция идёт в растворе в присутствии окислителей (O2, HNO3, KClO3):
- 4Cu + 4HCl + O2 →70−80oC 4CuCl + 2H2O
- Удобен способ восстановления меди (II) диоксидом серы:
- 2CuSO4 + 2NaCl + SO2 + 2H2O → 2CuCl↓ + 2H2SO4 + Na2SO4
- Восстановление сульфитом при избытке хлоридов:
- 2Cu2+ + 3Cl− + 3SO32− + H2O → 2CuCl↓ + 2SO42− + 2HSO3−
- Возможна реакция конпропорционирования:
- Возможно получение монохлорида меди термическим разложением дихлорида:
Химические свойства
- При кипячении суспензии монохлорида меди происходит реакция диспропорционирования:
- Монохлорид меди обратимо растворяется в соляной кислоте с образованием комплексного соединения:
- Монохлорид меди устойчив в сухом воздухе, но во влажном начинает окисляться до основного хлорида (который и придаёт кристаллам зелёный цвет):
- В кислой среде окисление приводит к образованию нормальных солей:
- 4CuCl + 4HCl + O2 →95oC 4CuCl2 + 2H2O
- Окисление можно проводить и горячей концентрированной азотной кислотой:
- Аммиачные растворы монохлорида меди поглощают ацетилен с образованием красного осадка:
- 2CuCl + C2H2 + 2NH3 → Cu2C2↓ + 2NH4Cl
- Кислые растворы монохлорида меди обратимо поглощают окись углерода:
Применение
- Монохлорид меди — промежуточный продукт при производстве меди.
- Поглотитель газов при очистке ацетилена, а также CO в газовом анализе.
- Катализатор в органическом синтезе, например при окислительном хлорировании метана или этилена, в производстве акрилонитрила.
- Антиоксидант для растворов целлюлозы.
Физиологическое действие
хлорид меди (I) ядовит. Может привести к тяжёлым отравлениям. Относится ко 2-му классу опасности.
