Дихромат натрия
дихромат натрия
| дихромат натрия | |
|---|---|
 |
|
| Традиционные названия | динатриевая соль дихромовой кислоты, динатрий дихромат (VI) |
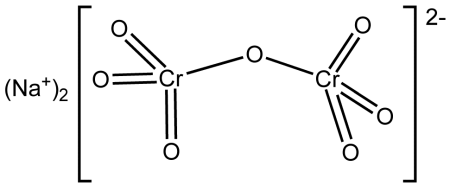
| Хим. формула | Na2Cr2O7 |
| Состояние | красные до оранжевых гигроскопичные кристаллы |
| Молярная масса |
(ангидрид) 261,968 г/моль (дигидрат) 298,00 г/моль |
| Плотность | 2,52 г/см³ |
| Т. плав. |
(ангидрид) 356,7 °C (дигидрат) около 100 °C |
| Т. разл. | 400 °C |
| Энтальпия образования | −1962 кДж/моль |
| Растворимость в воде | (при 20 °C) 236 г/100 мл |
| Растворимость в остальных веществах | растворим в спирте |
| ГОСТ | ГОСТ 2651-78 |
| Рег. номер CAS |
10588-01-9 (дигидрат) 7789-12-0 |
| PubChem | 25408 |
| Рег. номер EINECS | 234-190-3 |
| SMILES |
[O-][Cr](=O)(=O)O[Cr](=O)(=O)[O-].[Na+].[Na+]
|
| InChI |
1S/2Cr.2Na.7O/q;;2*+1;;;;;;2*-1
KIEOKOFEPABQKJ-UHFFFAOYSA-N
|
| Рег. номер EC | 234-190-3 |
| RTECS | HX7750000 (ангидрид, дигидрат) |
| ChEBI | 39483 |
| Номер ООН | 3288 |
| ChemSpider | 23723 |
| ЛД50 | 50 мг/кг |
| Токсичность |    |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
дихромат натрия (бихромат натрия, натриевый хромпик) — неорганическое химическое соединение, натриевая соль дихромовой кислоты. Существует дигидрат дихромата натрия (Na2Cr2O7·2H2O) и безводная соль.
Полупродукт в производстве хрома, практически вся хромовая руда перерабатывается в дихромат натрия.
Следует учитывать, что дихромат натрия очень токсичен.
Содержание
- 1 Свойства
- 1.1 Химические
- 2 Получение
- 3 Использование
- 4 Опасность применения
Свойства
Химические
С точки зрения реакционной способности и внешнего вида дихромат натрия и дихромат калия очень похожи. Соль натрия, однако, в двадцать раз лучше растворяется в воде, чем соль калия (49 г/л при 0 °C) и её эквивалентная масса также меньше — поэтому она является наиболее часто используемым веществом.
Схожестью хромовой кислоты и дихромата натрия является их общее свойство — они являются сильными окислителями. По отношению к калийной соли, основным преимуществом дихромата натрия является его большая растворимость в воде и в полярных растворителях, например таких как Уксусная кислота.
В области органического синтеза это соединение окисляет бензилы и аллильную группу C—H соединений до карбонильных производных. Так, например, 2,4,6-тринитротолуол окисляется до соответствующих карбоновых солей. Кроме того, 2,3-диметилнафталин (англ. 2,3-dimethylnaphthalene) окисляется в присутствии Na2Cr2O7 до 2,3-нафтилдикарбоновой кислоты (англ. 2,3-naphthalenedicarboxylic acid).
Получение
дихромат натрия образуется в больших масштабах из руд, содержащих оксид хрома III.
Сначала руду сплавляют, как правило, с карбонатом натрия при температуре около 1000 °C в присутствии воздуха (источник кислорода):
- 2Cr2O3 + 4Na2CO3 + 3O2 ⟶ 4Na2CrO4 + 4CO2
На данном этапе другие компоненты руды, такие как алюминий и железо, плохо растворимы. Окисление в результате реакции водного экстракта серной кислоты или углекислого газа даёт дихромат натрия, который выделяется как дигидрат при кристаллизации. Соединения хромаVI являются токсичными, в частности, при получении в виде пыли производящие его заводы могут быть подвержены строгим правилам. Например, чтобы снизить его токсичность, его сливают в сточные воды, где происходит восстановление с получением хромаIII, который является менее опасным для окружающей среды.
Использование
Используют при дублении кож и в электрических элементах, как компонент биозащитных составов для древесины.
Опасность применения
Как и все соединения шестивалентного хрома, дихромат натрия очень токсичен. Кроме того, он известный канцероген. Вещество очень токсично для водных организмов, может вызвать долговременные изменения в водной экосистеме.

