Тиосульфат натрия
Тиосульфат натрия
| Тиосульфат натрия | |||
|---|---|---|---|
|
|||
| Систематическое наименование |
Тиосульфат натрия | ||
| Традиционные названия | гипосульфит | ||
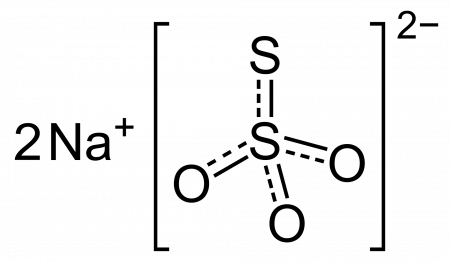
| Хим. формула | Na2S2O3, Na2S2O3·5H2O (кристаллогидрат) | ||
| Молярная масса | 158,11 г/моль | ||
| Плотность | 2,345 г/см³ | ||
| Температура | |||
| • плавления | 48,5 °С (пентагидрат) | ||
| • разложения | 300 °C | ||
| Растворимость | |||
| • в воде | 70,120; 22980 г/100 мл | ||
| Рег. номер CAS | 7772-98-7 | ||
| PubChem | 24477 | ||
| Рег. номер EINECS | 231-867-5 | ||
| SMILES |
[Na+].[Na+].[O-]S([O-])(=O)=S
|
||
| InChI |
1S/2Na.H2O3S2/c;;1-5(2,3)4/h;;(H2,1,2,3,4)/q2*+1;/p-2
AKHNMLFCWUSKQB-UHFFFAOYSA-L
|
||
| Кодекс Алиментариус | E539 | ||
| RTECS | XN6476000 | ||
| ChEBI | 132112 | ||
| ChemSpider | 22885 | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Тиосульфат натрия (антихлор, гипосульфит, сульфидотриоксосульфат натрия, натрий серноватистокислый) — неорганическое соединение, соль натрия и тиосерной кислоты c химической формулой Na2S2O3 или Na2SO3S, образует кристаллогидрат состава Na2S2O3·5H2O. Применяется в медицине, фотографии и других отраслях промышленности.
Содержание

Получение
- окислением полисульфидов Na;
- кипячение избытка серы с Na2SO3:
-
- Na2SO3 + S → Na2S2O3
- взаимодействием H2S и SO2 с NaOH (побочный продукт в производстве NaHSO3, сернистых красителей, при очистке промышленных газов от S):
-
- 4SO2 + 2H2S + 6 NaOH → 3Na2S2O3 + 5H2O
- кипячение избытка серы с гидроксидом натрия:
-
- 4 S + 6 NaOH → 2Na2S + Na2S2O3 + 3H2O
затем по приведённой выше реакции сульфит натрия присоединяет серу, образуя Тиосульфат натрия.
Одновременно в ходе этой реакции образуются Полисульфиды натрия (они придают раствору жёлтый цвет). Для их разрушения в раствор пропускают SO2.
- чистый безводный Тиосульфат натрия можно получить реакцией серы с нитритом натрия в формамиде. Эта реакция количественно протекает (при 80 °C за 30 минут) по уравнению:
-
- 2NaNO2 + 2 S → Na2S2O3 + N2O
- растворение сульфида натрия в воде в присутствии кислорода воздуха:
-
- 2Na2S + 2 O2 + H2O → Na2S2O3 + 2 NaOH
Физические и химические свойства
Имеет вид бесцветных кристаллов. Образует три модификации: моноклинную α (a = 0,8513, b = 0,8158, c = 0,6425, β = 97,08°, z = 4, пространственная группа P21/c), а также β и γ. α-модификация переходит в β при температуре 330 °C, β переходит в γ при 380 °C. Плотность α-модификации 2,345 г/моль.
Растворим в воде (50,1 г/100 мл (0 °C), 70,2 г/100 мл (20 °C), 231,8 г/100 мл (80 °C)).
Молярная масса 248,17 г/моль (пентагидрат). При 48,5 °C кристаллогидрат растворяется в своей кристаллизационной воде, образуя перенасыщенный раствор; обезвоживается около 100оС.
При нагревании до 220 °C распадается по схеме:
-
- 4Na2S2O3 → 3Na2SO4 + Na2S + 4 S
Тиосульфат натрия — сильный восстановитель:
С сильными окислителями, например, свободным хлором, окисляется до сульфатов или серной кислоты:
Более слабыми или медленно действующими окислителями, например, йодом, переводится в соли тетратионовой кислоты:
-
- 2Na2S2O3 + I2 → Na2S4O6 + 2 NaI
Приведённая реакция очень важна, так как служит основой йодометрии. Следует отметить, что в щелочной среде окисление тиосульфата натрия йодом может идти до сульфата.
Выделить тиосерную кислоту (тиосульфат водорода) реакцией тиосульфата натрия с сильной кислотой невозможно, так как она неустойчива и тут же разлагается на воду, серу и диоксид серы:
-
- Na2S2O3 + H2SO4 → Na2SO4 + H2O + S + SO2
Расплавленный кристаллогидрат Na2S2O3·5H2O очень склонен к переохлаждению.
Применение
- для удаления следов хлора после отбеливания тканей;
- для извлечения серебра из руд;
- фиксаж в фотографии;
- реактив в йодометрии;
- противоядие при отравлении: As, Br, Hg и другими тяжёлыми металлами, цианидами (переводит их в роданиды) и др.;
- для дезинфекции кишечника;
- для лечения чесотки (совместно с соляной кислотой);
- противовоспалительное и противоожоговое средство;
- как среда для определения молекулярных весов по понижению точки замерзания (криоскопическая константа 4,26°);
- в пищевой промышленности зарегистрирован в качестве пищевой добавки E539;
- добавки для бетона;
- для очищения тканей от йода;
- марлевые повязки, пропитанные раствором тиосульфатом натрия, использовали для защиты органов дыхания от отравляющего вещества хлора в Первую мировую войну;
- антидот при передозировке лидокаина.