Новости
Нефтегазовая пром.
01.04.2025
01.04.2025
Выставки
Наука и технология
31.03.2025
01.04.2025
31.03.2025
Теги
Полисульфиды натрия
Полисульфиды натрия
Полисульфиды натрия — неорганические соединения металла натрия с серой, жёлто-бурые кристаллы с формулой Na2Sn, где n=2-5.
Содержание
Получение
- Сплавлением сульфида натрия с серой получается смесь полисульфидов:
-
- Na2S + nS →τoC Na2Sn + 1
- результат можно контролировать количеством серы и температурой реакции: при 600°С получается Na2S2, при 400°С — Na2S4, при 200°С — Na2S5.
- Также можно провести синтез непосредственно из элементов в жидком аммиаке:
-
- 2 Na + n S →−30oC Na2Sn
Физические свойства
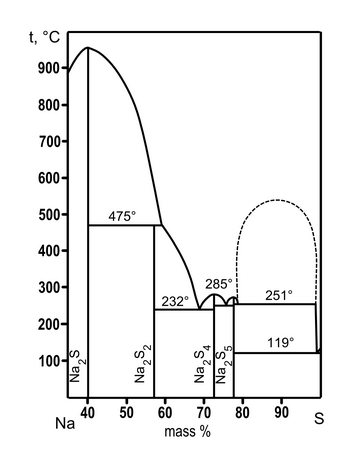
Фазовая диаграмма системы Na-S
Полисульфиды натрия — это твёрдые вещества цвета от жёлтого до жёлто-оранжевого. Хорошо растворяются в воде, высшие полисульфиды растворяются в этаноле.
| Полисульфид | Молярная масса | Температура плавления (°С) |
|---|---|---|
| Na2S2 | 110,11 | 445; 475; 490 |
| Na2S3•3H2O | 196,22 | разл. 100 |
| Na2S4 | 174,23 | 275; 285; 286 |
| Na2S5 | 206,31 | 255; 253; 260 |
Химические свойства
- При кристаллизации из водных растворов образуют кристаллогидраты: Na2S2•5H2O, Na2S3•3H2O, Na2S3•8H2O.
- При сильном нагревании разлагаются с выделением серы:
-
- Na2Sn →>600oC Na2S + (n − 1)S
- Водные растворы имеют щелочную реакцию из-за гидролиза по аниону:
-
- Sn2− + H2O ⇄ HSn− + OH−
- При комнатной температуре разлагаются разбавленными кислотами с выделением серы:
- При низкой температуре и концентрированной кислоте удаётся получить полисульфаны:
- Во влажной среде и на свету Полисульфиды натрия окисляются кислородом воздуха:
-
- 2Na2Sn + 2H2O + O2 → 4 NaOH + 2nS
- Без воды реакция окисления идёт иначе:
-
- 2Na2Sn + 3 O2 → 2Na2S2O3 + (2n − 4)S
Применение
- Для сульфидирования стальных и чугунных изделий.
- Для получения сернистых красителей.
- Синтез полисульфидных каучуков.
- Как компонент составов для обработки шкур.
- Как реагент при флотационном разделении смесей.
- Как инсектофенгициды.
- В аналитической химии.