Ацетат натрия
Ацетат натрия
| Ацетат натрия | |
|---|---|
 |
|
| Систематическое наименование |
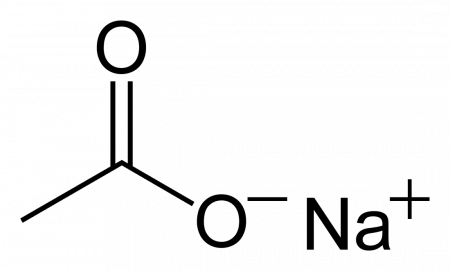
sodium acetate (ИЮПАК) sodium ethanoate (систематическое) Ацетат натрия натрия этаноат Натрий уксуснокислый |
| Хим. формула | C2H3O2Na |
| Рац. формула | CH3COONa |
| Состояние | белый гигроскопичный порошок |
| Молярная масса | 82.03 грамм/моль (безводная форма) 136.08 грамм/моль (тригидрат) г/моль |
| Плотность | 1,45 г/см³ |
| Температура | |
| • плавления | 328 °C |
| • разложения | 324 °C |
| Удельная теплота плавления | 264—289 кДж/кг |
| Растворимость | |
| • в воде | 76 г/100 мл |
| Рег. номер CAS | 127-09-3 |
| PubChem | 517045 |
| Рег. номер EINECS | 204-823-8 |
| SMILES |
CC(=O)[O-].[Na+]
|
| InChI |
1S/C2H4O2.Na/c1-2(3)4;/h1H3,(H,3,4);/q;+1/p-1
VMHLLURERBWHNL-UHFFFAOYSA-M
|
| Кодекс Алиментариус | E262 |
| ChEBI | 32954 |
| ChemSpider | 29105 |
| Токсичность | ирритант, малотоксичен |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Ацетат натрия CH3COONa, — натриевая соль уксусной кислоты, кристаллы со слабым солёным вкусом и уксусным запахом, производится и применяется в промышленных масштабах.
Содержание
Область применения
Ацетат натрия используется в текстильном производстве для нейтрализации отработанной серной кислоты в сточных водах и как фоторезист при использовании анилиновых красителей. Также используется при дублении солями хрома (для протравливания), и замедляет процесс вулканизации хлоропрена при производстве синтетических резин.
Ацетат натрия известен как пищевая добавка E262 и применяется как консервант.
Также Ацетат натрия является источником углерода для бактерий, выращиваемых на питательной среде.
В растворе Ацетат натрия (будучи солью слабой кислоты) и Уксусная кислота могут применяться как буфер, для сохранения относительно постоянного pH. Это особенно полезно в биохимии в pH-зависимых реакциях.
Ацетат натрия также используется в быту как составная химических грелок (англ. heating pad) или химических обогревателей (англ. Hand warmer), применяется как составная часть смеси «горячего льда» (англ. «hot ice»), при кристаллизации ацетата натрия выделяется тепло — это экзотермический процесс. При нагреве тригидрата ацетата натрия (имеющего точку плавления в 58 °C) до 100 °C (обычно ёмкость с ним кладут в кипящую воду) он расплавляется (вернее, растворяется в собственной кристаллизационной воде) и переходит в водный раствор ацетата натрия. При охлаждении этого раствора образуется перенасыщенный раствор ацетата натрия в воде. Этот раствор прекрасно переохлаждается до комнатной температуры без образования твёрдой фазы, затем нажатием на металлический диск в ёмкости образуется центр кристаллизации, который, вырастая, заставляет перенасыщенный раствор переходить в твёрдую фазу тригидрата ацетата натрия. Этот процесс сопровождается значительным выделением тепла (экзотермическая реакция), теплота фазового перехода составляет 264-289 кДж/кг.
На этом свойстве основан довольно красивый химический опыт — «горячий лёд».
Способы получения
- В лабораторных условиях Ацетат натрия образуется при взаимодействии уксусной кислоты, например, с карбонатом натрия, гидрокарбонатом натрия или гидроксидом натрия.
-
- CH3COOH + NaHCO3 ⟶ CH3COONa + H2O + CO2↑
Это — хорошо известная реакция «гашения» пищевой соды и винного уксуса, происходящая в тесте. 84 г гидрокарбоната натрия реагируют с 750 г 8%-го винного уксуса (или же с 86 г 70%-й уксусной эссенции) с образованием 82 г ацетата натрия в растворе. Выпариванием воды можно получить чистый кристаллический Ацетат натрия. Для получения тригидрата ацетата натрия без выпаривания необходимо смешать 84 г гидрокарбоната натрия (пищевой соды) с 86 г 70%-ной уксусной кислоты и 10 г воды.
- Также Ацетат натрия может быть получен и в ходе экзотермической реакции растворения металлического натрия в уксусной кислоте:
-
- 2CH3COOH + 2Na ⟶ 2CH3COONa + H2↑ + Q
Характерные реакции
Ацетат натрия может быть использован для образования сложного эфира по реакции с алкилгалогенидами, такими как, например, бромэтан:
-
- CH3COONa + CH3CH2Br → CH3COOC2H5 + NaBr
При сильном нагревании (более 324 °C) Ацетат натрия разлагается на Карбонат натрия и Ацетон:
Влияние на организм
Ацетат натрия может всасываться в организм при проглатывании. Является ирритантом. LD50 25956 мг/кг. По другим данным из того же источника: LD50(крысы, орально): 3500 мг/кг, LD50(мыши, орально): 4960 мг/кг.



