Фторид меди (II)
Фторид меди (II)
| Фторид меди (II) | |
|---|---|
   |
|
| Систематическое наименование |
меди (II) фторид |
| Сокращения | фторомедь (II) |
| Традиционные названия | Дифторид меди |
| Хим. формула | CuF2 |
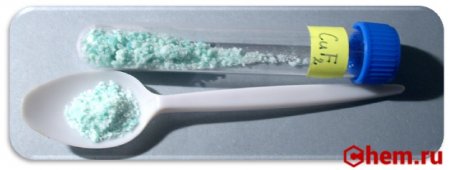
| Состояние |
(безводный) белый кристаллический порошок (дигидрат) синий цвет |
| Молярная масса |
(безводный) 101.543 г/моль (дигидрат) 137.573 г/моль |
| Плотность |
(безводный) 4,23 г/см³ (дигидрат) 2,934 г/см³ |
| Температура | |
| • плавления | (безводный) 950 °C, (дигидрат) 130 |
| • кипения | (безводный) 1676 °C |
| Мол. теплоёмк. | (при 298,15 K) 65.815 Дж/(моль·К) |
| Энтальпия | |
| • образования | −538.9 ± 1.3 кДж/моль |
| Растворимость | |
| • в воде | в хол. воде 0,08 г/100 мл |
| • в других веществах | растворяется в аммиаке, фтороводородной, хлороводородной и азотной кислотах; пиридине, этилацетате |
| Рег. номер CAS | 7789-19-7, 13454-88-1 (дигидрат) |
| PubChem | 522688 |
| Рег. номер EINECS | 232-147-3 |
| SMILES |
[Cu+2].[FH-].[FH-]
|
| InChI |
1S/Cu.2FH/h;2*1H/q+2;;/p-2
GWFAVIIMQDUCRA-UHFFFAOYSA-L
|
| ChemSpider | 74214 и 455944 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Фторид меди (II) — это неорганическое бинарное химическое соединение. Химическая формула CuF2.
Содержание
Физические свойства
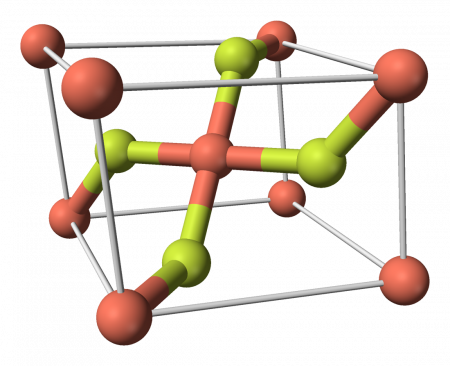
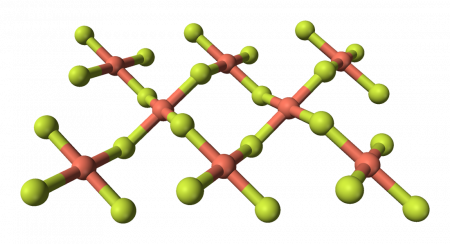
Безводный фторид меди это белые гигроскопические кристаллы кубической сингонии, пространственная группа Fm3m, a = 0,5417 нм, Z=4, структура типа CaF2.
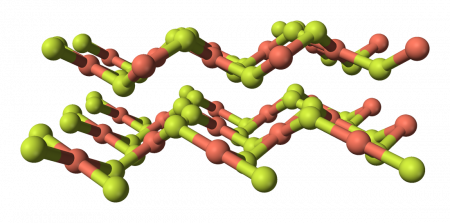
Образует кристаллогидрат CuF2·2H2O — светло-голубые кристаллы, при нагревании плавится в собственной воде.
Получение
Фторид меди (II) можно получить из гидроокиси меди:
- Cu(OH)2 + 2HF → CuF2 + H2O
Фторид меди(I) при нагревании диспропорционирует:
- 2CuF →to CuF2 + Cu
Фторид меди (II) можно синтезировать непосредственно из элементов:
- Cu + F2 →400oC CuF2
При температуре в 400 °C фтор вытесняет из хлорида меди (II) хлор:
При температуре в 375 °C фторид азота (III) с медью реагирует с образованием тетрафторгидразина и фторида меди (II):
- 2NF3 + Cu →375oC N2F4 + CuF2
Химические свойства
Восстанавливается до меди водородом:
- CuF2 + H2 → Cu + 2HF
Разлагается парами воды.
Взаимодействует с щелочами:
- CuF2 + 2NaOH → Cu(OH)2 + 2NaF
Соединение теряет фтор будучи расплавленным в температурах выше 950 °C:
- 2CuF2 →950oC 2CuF + F2↑
В растворах, содержащих фторид-ион F−, образует комплексные анионы, например, CuF3−, CuF42− и CuF64−:
Применение
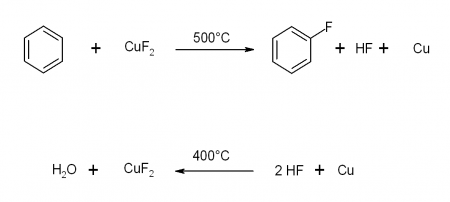
Было выяснено, что ароматические углеводороды реагируют со фторидом меди (II) в кислородсодержащей атмосфере при температурах выше 450 °C, образуя фторированные ароматические углеводороды.
Данная реакция, показанная на рисунке слева, является более простой, чем реакция Сандмайера, но применима только для соединений, которые являются достаточно стабильными при высоких температурах.
Применяется в качестве инсектицида и в производстве керамики.