Желтая кровяная соль
желтая кровяная соль
| калий железистосинеродистый | |
|---|---|
 |
|
 |
|
| Систематическое наименование |
Гексацианоферрат(II) калия |
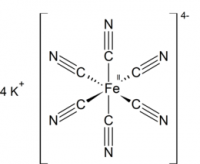
| Хим. формула | K4[Fe(CN)6] |
| Рац. формула | C6N6FeK4 |
| Состояние | безводный — бесцветные кристаллы, тригидрат — бледно-жёлтые кристаллы |
| Молярная масса | 368,35 г/моль |
| Плотность | тригидрата 1,85 г/см³ |
| Т. плав. | 69-71 °C |
| Т. разл. | ~650 °C |
| ГОСТ | ГОСТ 4207-75 ГОСТ 6816-79 |
| Рег. номер CAS | 13943-58-3 |
| PubChem | 9605257 |
| Рег. номер EINECS | 237-722-2 |
| SMILES |
[C-]#N.[C-]#N.[C-]#N.[C-]#N.[C-]#N.[C-]#N.[K+].[K+].[K+].[K+].[Fe+2], [C]#N.[C]#N.[C]#N.[C]#N.[C]#N.[C]#N.[Fe-4].[K+].[K+].[K+].[K+]
|
| InChI |
1S/6CN.Fe.4K/c6*1-2;;;;;/q6*-1;+2;4*+1, 1S/6CN.Fe.4K/c6*1-2;;;;;/q;;;;;;-4;4*+1
XOGGUFAVLNCTRS-UHFFFAOYSA-N, OCPOWIWGGAATRP-UHFFFAOYSA-N
|
| Кодекс Алиментариус | E536 |
| ChEBI | 30059 |
| ChemSpider | 7879375 и 20162028 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Гексацианоферрат (II) калия (железистосинеродистый калий, ферроцианид калия, гексацианоферроат калия, жёлтая кровяная соль) — комплексное соединение двухвалентного железа K4[Fe(CN)6], существующее обычно в виде тригидрата K4[Fe(CN)6]·3H2O.
Содержание
- 1 История открытия и тривиальные названия
- 2 Получение
- 3 Химические свойства
- 4 Токсичность
- 5 Применение
- 6 Мнемоническое правило

История открытия и тривиальные названия
- жёлтая кровяная соль — кристаллогидрат K4[Fe(CN)6]·3H2O.
- жёлтое синькали
- жёлтая соль
- кровещелочная соль
Тривиальное название появилось из-за того, что ранее «жёлтую кровяную соль» получали путём сплавления отходов с боен (в частности, крови) с поташом и железными опилками. Это, а также жёлтый цвет кристаллов, обусловили название соединения.
Получение
В настоящее время в промышленности получают из отработанной массы после очистки газов на газовых заводах (содержит цианистые соединения); эту массу обрабатывают суспензией Ca(OH)2; фильтрат, содержащий Ca2[Fe(CN)6], перерабатывают путём последовательного добавления сначала KCl, а затем K2CO3.
Он также может быть получен путём взаимодействия суспензии FeS с водным раствором KCN. Реакцию можно представить следующей схемой:
1. Цианид калия переводит Fe2+ в белый осадок гексацианоферрата(II) железа(II) (а не в цианид железа(II), как считалось ранее, что вытекает из взаимодействия этого цианида со щёлочью: 3Fe(CN)2 + 4KOH → 2Fe(OH)2↓ + K4[Fe(CN)6]):
- 3Fe2+ + 6CN− → Fe2[Fe(CN)6]↓
2. затем осадок растворяется в избытке KCN с образованием «жёлтой кровяной соли»:
- Fe2[Fe(CN)6] + 12CN− → 3[Fe(CN)6]4−

Химические свойства
Светло-жёлтые кристаллы с тетрагональной решеткой, существующие в виде тригидрата K4[Fe(CN)6]·3H2O.
Плотность 1,853 г/см³ при 17 °C. Растворимость в воде 31,5 г/100 г при 25 °C, 48,3 г при 50 °C. Практически не растворяется в эфире, этаноле, пиридине, анилине, этилацетате.
Гексацианоферрат(II) калия диамагнитен.
Выше 87,3 °C (по другим данным, выше 120 °C) превращается в безводную соль с плотностью 1,935 г/см³. Выше 650 °C разлагается:
- 3K4[Fe(CN)6] →(t) Fe3C + 5C + 3N2↑ + 12KCN
В реакции с соляной кислотой выделяется белый осадок железистосинеродистой кислоты (H4[Fe(CN)6]).
С концентрированной серной кислотой реагирует по уравнению:
- K4[Fe(CN)6] + 6H2SO4 + 6H2O →(t) 2K2SO4 + FeSO4 + 3(NH4)2SO4 + 6CO↑.
Этим способом можно пользоваться в лаборатории для получения монооксида углерода.
С солями металлов в степени окисления +2 и +3, образует малорастворимые соединения гексацианоферратов(II) (см. в разделе «применение»).
В водных растворах окисляется хлором и другими окислителями, такими, как пероксид водорода до K3[Fe(CN)6]:
- 2K4[Fe(CN)6] + H2O2 + 2HCl → 2K3[Fe(CN)6] + 2KCl + 2H2O
Анион [Fe(CN)6]4− очень прочен (константа нестойкости 8⋅10-36), не разлагается ни щелочами, ни кислотами, устойчив по отношению к воздуху; поэтому растворы ферроцианидов не показывают реакций ни на Fe2+, ни на CN−.
Токсичность
Нейтральное вещество, не разлагается в воде и внутри человеческого организма. Летален при приёме перорально дозы в 6400 мг/кг (испытания на крысах).

Применение
Применяют при изготовлении пигментов, крашении шёлка, в производстве цианистых соединений, ферритов, цветной бумаги, как компонент ингибирующих покрытий и при цианировании сталей, для выделения и утилизации радиоактивного цезия.
В Российской Федерации широко применяют при производстве продуктов питания - соли, творожных продуктов, в виноделии и пр.
Гексацианоферрат(II) калия применяется в аналитической химии как реактив для обнаружения некоторых катионов:
1. Fe3+: образуется малорастворимый синий осадок «берлинской лазури»:
- FeIIICl3 + K4[FeII(CN)6] → KFeIII[FeII(CN)6] + 3KCl,
или, в ионной форме
- Fe3+ + [Fe(CN)6]4− → Fe[Fe(CN)6]−
Получающийся гексацианоферрат(II) калия-железа(III) слабо растворим (с образованием коллоидного раствора), поэтому носит название «растворимая Берлинская лазурь».
2. Zn2+: образуется белый осадок гексацианоферрата(II) цинка-калия:
- 3ZnCl2 + 2K4[FeII(CN)6] → K2Zn3[Fe(CN)6]2↓ + 6KCl,
или, в ионной форме
- 3Zn2+ + 2K+ + 2[Fe(CN)6]4− → K2Zn3[Fe(CN)6]2↓
3. Cu2+: из нейтральных или слабокислых растворов выпадает красно-бурый осадок гексацианоферрата(II) меди(II):
- 2CuCl2 + K4[FeII(CN)6] → Cu2[Fe(CN)6]↓ + 4KCl,
или, в ионной форме
- 2Cu2+ + [Fe(CN)6]4− → Cu2[Fe(CN)6]↓
В пищевой промышленности ферроцианид калия зарегистрирован в качестве пищевой добавки E536, препятствующей слёживанию и комкованию. Применяется как добавка к поваренной соли.

Мнемоническое правило
Для того, чтобы запомнить формулу желтой кровяной соли K4[Fe(CN)6] и не спутать её с красной кровяной солью K3[Fe(CN)6], существует мнемоническое правило:
- Число атомов калия соответствует числу букв в английских названиях солей: «gold» — 4 буквы, то есть 4 атома калия — желтая кровяная соль (калий железистосинеродистый) K4[Fe(CN)6]. «Red» — 3 буквы, то есть 3 атома калия — красная кровяная соль (калий железосинеродистый) — K3[Fe(CN)6].
