Сульфид железа (II)
Сульфид железа (II)
| Сульфид железа (II) | |
|---|---|
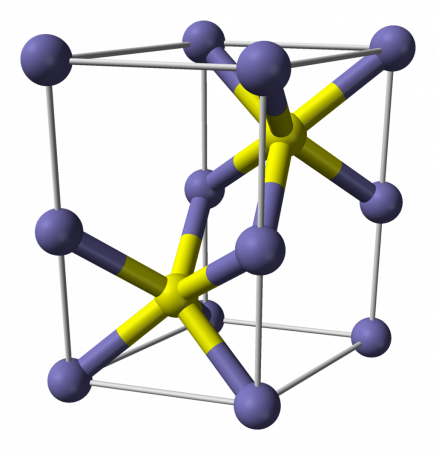 |
|
| Систематическое наименование |
Сульфид железа (II) |
| Хим. формула | FeS |
| Состояние | твёрдое |
| Молярная масса | 87,910 г/моль |
| Плотность | 4,84 г/см³ |
| Температура | |
| • плавления | 1194 °C |
| Рег. номер CAS | 1317-37-9 |
| PubChem | 14828 |
| Рег. номер EINECS | 215-268-6 |
| SMILES |
[Fe+2].[S-2]
|
| InChI |
1S/Fe.S
MBMLMWLHJBBADN-UHFFFAOYSA-N
|
| ChemSpider | 8466211 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Сульфид железа (II) — сложное неорганическое вещество с химической формулой FeS класса неорганических сульфидов .
Содержание
Описание и структура
Сульфид железа (II) — бескислородная соль. Кристаллы чёрного цвета с металлическим блеском и гексагональной кристаллической решёткой, тугоплавкий, разлагается при нагревании в вакууме. Во влажном состоянии чувствителен к кислороду воздуха. Нерастворим в воде. Не выпадает в осадок при насыщении растворов солей железа (II) сероводородом. Разлагается кислотами. Применяется как сырье в производстве чугуна, твердый источник сероводорода. Не притягивается магнитом.
Получение
1. Взаимодействие железа с серой:
-
- Fe + S ⟶ FeS
Реакция начинается при нагревании смеси железа с серой в пламени горелки, далее может протекать и без подогрева, с выделением теплоты.
2. Взаимодействие оксида железа (III) с водородом и сероводородом:
-
- Fe2O3 + H2 + 2H2S ⟶ 2FeS + 3H2O
Химические свойства
1. Взаимодействие с концентрированной HCl:
-
- FeS + 2HCl ⟶ FeCl2 + H2S
2. Взаимодействие с концентрированной HNO3:
-
- FeS + 12HNO3 ⟶ Fe(NO3)3 + 9NO2 + 5H2O + H2SO4
Применение
Сульфид железа (II) служит обычным исходным продуктом при получении сероводорода в лабораторных условиях. Гидросульфид железа [Fe(SH)2] и/или отвечающая ему основная соль [Fe(SH)OH] является важнейшей составной частью некоторых лечебных грязей.

