Сульфат аммония
Сульфат аммония
| Сульфат аммония | |
|---|---|
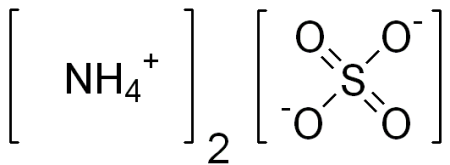 |
|
| Систематическое наименование |
аммония сульфат |
| Традиционные названия | Аммоний сернокислый |
| Хим. формула | (NH4)2SO4 |
| Рац. формула | H8N2O4S |
| Состояние | твёрдое |
| Молярная масса | 132,14052 г/моль |
| Плотность | 1,769 г/см³ (20 °C) |
| Т. плав. | 235-280 °C |
| Т. разл. | 218 °C |
| Мол. теплоёмк. | 187,4 Дж/(моль·К) |
| Энтальпия образования | −1180,26 кДж/моль |
| Растворимость в воде | 75,4 г/100 г (20 °C) |
| ГОСТ | ГОСТ 9097-82 ГОСТ 3967-78 ГОСТ 10873-73 ГОСТ Р 51520-99 |
| Рег. номер CAS | 7783-20-2 |
| PubChem | 24538 |
| Рег. номер EINECS | 231-984-1 |
| SMILES |
O=S(=O)(O)O.N.N
|
| InChI |
1S/2H3N.H2O4S/c;;1-5(2,3)4/h2*1H3;(H2,1,2,3,4)
BFNBIHQBYMNNAN-UHFFFAOYSA-N
|
| Кодекс Алиментариус | E517 |
| ChEBI | 62946 |
| ChemSpider | 22944 |
| ЛД50 | 2840 (крысы; орально) |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Сульфат аммония (Аммоний сернокислый, лат. ammonium sulphate), (NH4)2SO4 — неорганическое бинарное соединение, аммонийная соль серной кислоты. Это бесцветные прозрачные кристаллы (или белый порошок) без запаха. Получают Сульфат аммония действием серной кислоты на раствор аммиака и обменными реакциями с другими солями. Применяется в качестве удобрения, при производстве вискозы, в пищевой промышленности, при очистке белков в биохимии, в качестве добавки при хлорировании водопроводной воды. Токсичность сульфата аммония очень низкая.
Содержание
- 1 Физические свойства
- 2 Химические свойства
- 3 Получение
- 4 Очистка
- 5 Применение
- 6 Воздействие на человека

Физические свойства
Чистый Сульфат аммония — бесцветные прозрачные кристаллы, в измельчённом виде — белый порошок. Запаха не имеет. Гигроскопичность невысокая.
Образует кристаллы ромбической сингонии, пространственная группа Pnma, параметры ячейки a = 0,7782 нм, b = 0,5993 нм, c = 1,0636 нм, Z = 4.
Плотность (при 20 °C) — 1,766 г/см3.
Растворимость в воде (г/100 мл):
- 70,1 (0 °C)
- 72,7 (10 °C)
- 75,4 (20 °C)
- 76,9 (25 °C)
- 78,1 (30 °C)
- 81,2 (40 °C)
- 84,3 (50 °C)
- 87,4 (60 °C)
- 94,1 (80 °C)
- 102 (100 °C).
Растворимость в других растворителях (г/100 г):
- муравьиная кислота 95 %: 25,4 (16,5 °C);
- Ацетон: нерастворим;
- Этанол: нерастворим;
- диэтиловый эфир: нерастворим.
Сульфат аммония с солями некоторых других металлов (алюминий, железо и пр.) образует двойные соли, например алюмоаммиачные квасцы, Соль Мора.
Химические свойства
При нагревании до 147 °С Сульфат аммония разлагается на соответствующий гидросульфат NH4HSO4 и аммиак по схеме:
-
- (NH4)2SO4 → NH4HSO4 + NH3↑
При повышении температуры выше 500 °С Гидросульфат аммония кипит с разложением на серный ангидрид, аммиак и воду:
-
- NH4HSO4 →>500oC NH3 + SO3 + H2O
Сульфат аммония окисляется до молекулярного азота сильными окислителями, например перманганатом калия.
Получение
В лаборатории получают действием концентрированной серной кислоты на концентрированный раствор аммиака.
-
- 2NH3 + H2SO4 → (NH4)2SO4
Эту реакцию, как и все другие реакции взаимодействия аммиака с кислотами, проводят в приборе для получения растворимых веществ в твёрдом виде.
Среди основных способов получения сульфата аммония, которые наиболее часто используются в химической промышленности, имеются следующие: процесс нейтрализации серной кислоты синтетическим аммиаком; использование аммиака из газа коксовых печей для его химической реакции с серной кислотой; получение в результате обработки гипса растворами карбоната аммония; получение при переработке отходов, остающихся после производства капролактама. Вместе с тем имеются и другие способы производства сульфата аммония, например, получение этого вещества из дымовых газов электростанций и сернокислотных заводов. Для этого в горячие газы вводят газообразный аммиак, который связывает имеющиеся в газе окислы серы в различные соли аммония, в том числе и в Сульфат аммония.
Очистка
Технический Сульфат аммония часто загрязнен сульфатом железа. Избавиться от него простой перекристаллизацией невозможно, так как соли железа сокристаллизуются с сульфатом аммония, образуя двойную Соль Мора.
Согласно Карякину, для очистки препарата 150 г его растворяют в 260 мл дистиллированной воды, нагревают до кипения, прибавляют 1-2 г пероксодисульфата аммония и кипятят до полного окисления железа (II) в железо (III). Полноту окисления необходимо проверить прибавлением к отфильтрованной пробе раствора гексацианоферрата (III) калия (красной кровяной соли) — синее окрашивание пробы указывает на неполноту окисления железа, в таком случае процесс очистки следует повторить.
После перехода всего железа в трехвалентное к раствору следует прибавить крепкий раствор аммиака до сильно щелочной реакции и отфильтровать. Полученный раствор упарить до консистенции жидкой кристаллической кашицы и дать охладиться до комнатной температуры. Кристаллы отсосать на воронке Бюхнера и промыть несколько раз дистиллированной водой.
В полученном реактиве может содержаться до 0,2 % сульфата кальция, который отделить никак не удастся.
Применение
Сульфат аммония широко применяется как азотное-серное минеральное удобрение (в РФ — по ГОСТ-9097-82) в легкоусвояемой форме, не содержащей NO3--групп и не едкое, его можно применять в любое время года. Содержит 21 % азота и 24 % серы. Подкисляет почву.
Также используется в производстве вискозного волокна как компонент осадительной ванны.
В биохимии переосаждение сульфатом аммония является общим методом очистки белков.
В пищевой промышленности зарегистрирован в качестве пищевой добавки E517.
Сульфат аммония используется в технологии хлорирования воды с аммонизацией — его вводят в обрабатываемую воду за несколько секунд до хлора. С хлором он образует хлорамины, связывая свободный хлор, благодаря чему значительно сокращается образование хлорорганики, вредной для организма человека, сокращается расход хлора, уменьшается коррозия труб водопровода.
Сульфат аммония является компонентом порошковых огнетушителей и огнезащитных средств.
Кроме того, находит применение при получении марганца электролизом, в производстве аммониево-алюминиевых квасцов, корунда. Добавляется к стекольной шихте для улучшения её плавкости.

Воздействие на человека
Сульфат аммония признаётся безопасным для человека и используется в качестве пищевой добавки в России, на Украине и в странах ЕС. Сульфат аммония используется в качестве заменителя соли и носит название пищевой добавки E517. В пищевой индустрии добавка Сульфат аммония выступает в роли улучшителя качества муки и хлебобулочных изделий, увеличивая также их объём, является питанием для дрожжевых культур, применяется как стабилизатор и эмульгатор.




