Трифторид алюминия
Трифторид алюминия
| Трифторид алюминия | |||
|---|---|---|---|
|
|||
| Традиционные названия | Трифторид алюминия, Фторид алюминия, алюминия трифторид | ||
| Хим. формула | AlF3 | ||
| Состояние | белое твердое кристаллическое вещество без запаха | ||
| Молярная масса |
(ангидрид) 83.9767 (моногидрат) 101.022 (тригидрат) 138.023 г/моль |
||
| Плотность | 2,88 г/см³ | ||
| Температура | |||
| • плавления | 1291 °C | ||
| Мол. теплоёмк. | 75,10 Дж/(моль·К) | ||
| Энтальпия | |||
| • образования | −1510 кДж/моль | ||
| Удельная теплота испарения | (возгонка) 272 Дж/кг | ||
| Растворимость | |||
| • в воде | (при 0 °C) 0.56 (при 20 °C) 0.67 (при 100 °C) 1.72 г/100 мл |
||
| Кристаллическая структура | ромбоэдрическая | ||
| Рег. номер CAS |
7784-18-1 (ангидрид), 32287-65-3 (моногидрат) 15098-87-0 (тригидрат) |
||
| PubChem | 2124 | ||
| Рег. номер EINECS | 232-051-1 (ангидрид) | ||
| SMILES |
F[Al](F)F
|
||
| InChI |
1S/Al.3FH/h;3*1H/q+3;;;/p-3
KLZUFWVZNOTSEM-UHFFFAOYSA-K
|
||
| RTECS | BD0725000 | ||
| ChEBI | 49464 | ||
| ChemSpider | 2039 | ||
| Предельная концентрация | 2 мг/м3 | ||
| ЛД50 | 100 мг/кг (крысы, орально) | ||
| Пиктограммы ECB |    |
||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Фторид алюминия — неорганическое бинарное соединение алюминия и фтора. Химическая формула AlF3.
Содержание
Физические свойства
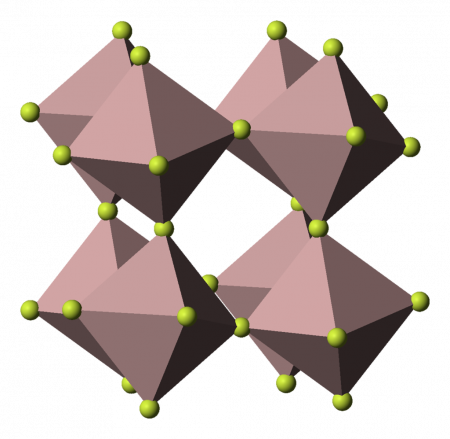
Фторид алюминия представляет собой бесцветное или белое кристаллическое вещество. При сильном нагревании возгоняется без разложения. При обычных условиях устойчива α-модификация с тригональной решеткой (а = 0,5039 нм, α = 58,50°, z = 2, пространственная группа R32), плотность 2,882 г/см³. При нагревании до ~700 °C переходит в γ-модификацию с тетрагональной решеткой (а = 0,354 нм, с = 0,600 нм).
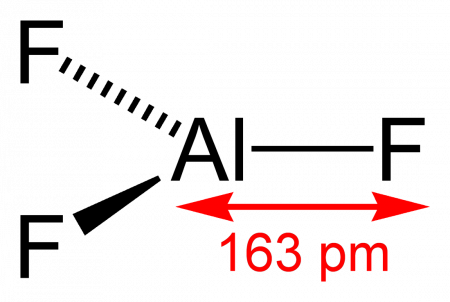
Длина связи Al—F составляет 0,163 нм. В газовой фазе, при температуре около 1000 °C, Трифторид алюминия существует в виде молекул тригональной симметрии D3h.
Фторид алюминия плохо растворим в воде (0,41 % по массе при 25 °C), лучше — в растворах HF, не растворим в органических растворителях.
Получение
Взаимодействием Аl2O3 или Аl(ОН)3 с раствором HF с последующим выделением, сушкой и прокаливанием при 500-600 °C образовавшегося кристаллогидрата AlF3·3H2O:
-
- Al(OH)3 + HF → AlF3 ⋅ 3 H2O →500oC AlF3 + 3 H2O
Действием на Аl2O3 газообразного HF при 450-600 °C:
-
- Al2O3 + 6 HF →450−600oC 2 AlF3 + 3 H2O
По реакции:
-
- 2 Al(OH)3 + H2SiF6 →H2O 2 AlF3 ⋅ 3 H2O + SiO2 ⋅ nH2O
с последующем выделением, сушкой и прокаливанием гидрата.
При температуре в 700 °C гексафторсиликат натрия с алюминием дают на выходе чистый кремний, гексафторалюминат натрия и Трифторид алюминия:
-
- 3 Na2[SiF6] + 4 Al →700oC 3 Si + 2 Na3[AlF6] + 2 AlF3
Самым легким путём получения трифторида алюминия является прямой контакт фтора с алюминием при температуре 600 °C:
-
- 2 Al + 3 F2 →600oC 2 AlF3
Нагрев до температуры примерно 175 °C моногидрат трифторида алюминия получим воду и Трифторид алюминия:
-
- AlF3 ⋅ H2O →175oC AlF3 + H2O
Для получения чистого безводного трифторида алюминия нужно гексафторалюминат аммония нагреть и получится Трифторид алюминия с фторидом аммония:
-
- (NH4)3AlF6 ⟶ AlF3 + 3 NH4F
В основном Трифторид алюминия получают при обработке оксида алюминия гексафторсиликоновой кислотой, где на выходе получается оксид кремния IV, Трифторид алюминия и Вода:
-
- H2SiF6 + Al2O3 ⟶ 2 AlF3 + SiO2 + H2O
Кроме того, он изготавливается путём термического разложения аммония гексафторалюмината.
Химические свойства
Образует кристаллогидраты с 1, 3 и 9 молекулами воды, которые легко разрушаются при нагревании:
-
- AlF3 ⋅ H2O →150−200oC AlF3 + H2O
При нагревании гидролизуется парами воды:
-
- AlF3 + 3 H2O →400oC Al(OH)3 + 3 HF
Медленно взаимодействует с концентрированной серной кислотой H2SO4:
-
- 2 AlF3 + 3 H2SO4 → Al2(SO4)3 + 6 HF
Разлагается растворами и расплавами щелочей.
-
- AlF3 + 3(NH3 ⋅ H2O) → Al(OH)3 + 3 NH4F
- 4 AlF3 + 4 NaOH → Na[Al(OH)4] + 3 Na[AlF4]
С фторидами щелочных металлов AlF3 образует фтороалюминаты, например, гексафтороалюминат натрия Na3[AlF6]:
-
- AlF3 + 3 NaF → Na3[AlF6]
Применение
- Трифторид алюминия используется как компонент электролита (примерно 5-15 %) при электролитическом производстве алюминия. Совместно с другими применяемыми добавками в электролит (Фторид кальция, Фторид магния, Фторид лития), он уменьшает температуру плавления электролита до 930-950 °C и повышает эффективность процесса электролиза (увеличивается выход по току, уменьшается удельный расход электроэнергии).
- Входит в состав флюсов, эмалей, стекол, глазурей, керамики, покрытий сварочных электродов; является катализатором в органическом синтезе.
- Как антисептик для предотвращения брожения;
- В производстве киноплёнки.