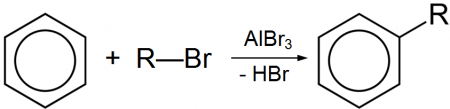Бромид алюминия
Бромид алюминия
| Бромид алюминия | |||
|---|---|---|---|
|
|||
| Систематическое наименование |
Бромид алюминия | ||
| Хим. формула | AlBr3, Al2Br6 | ||
| Рац. формула | AlBr3 | ||
| Состояние | твёрдое | ||
| Молярная масса | 266,69 г/моль | ||
| Плотность | 3,205 | ||
| Температура | |||
| • плавления | 97,5 | ||
| • кипения | 255 °C | ||
| Энтальпия | |||
| • образования | − 514; − 422 (AlBr3, газ); − 971(Al2Br6, газ) кДж/моль |
||
| Кристаллическая структура | моноклинная | ||
| Рег. номер CAS | 7727-15-3 | ||
| PubChem | 24409 | ||
| Рег. номер EINECS | 231-779-7 | ||
| SMILES |
[Al](Br)(Br)Br
|
||
| InChI |
1S/Al.3BrH/h;3*1H/q+3;;;/p-3
PQLAYKMGZDUDLQ-UHFFFAOYSA-K
|
||
| RTECS | BD0350000 | ||
| Номер ООН | 1725 | ||
| ChemSpider | 22818 | ||
| Пиктограммы ECB |    |
||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Бромид алюминия (бромистый алюминий) — это неорганическое бинарное соединение. Химическая формула Al+3Br3−1. Вещество представляет собой соль алюминия и бромоводородной кислоты. В твердом и жидком состоянии существует в форме димера: Al2Br6.
Содержание
Физические свойства
Безводный Бромид алюминия представляет собой бесцветное кристаллическое вещество, плавящееся при температуре 97,5 °C; температура кипения: 255 °C.
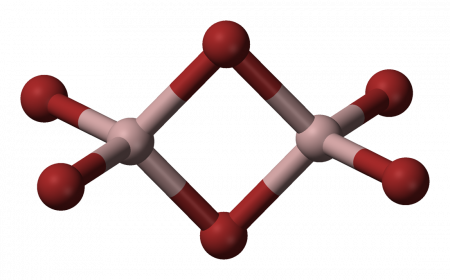
В твёрдой и жидкой фазе существует в форме димера Al2Br6, частично диссоциирующего в AlBr3, в газовой фазе масс-спектры показывают наличие ди-, тетра- и гексаформ: Al2Br6, Al4Br12, Al6Br18 соответственно.
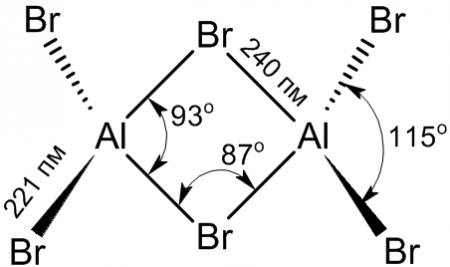
Структура молекулы бромида алюминия Al2Br6 представляет собой сдвоенные тетраэдры, в центре которых расположены атомы алюминия, ковалентно связанные с атомами брома.
Координационное число алюминия в молекуле бромида равно 4.
Энергия разрыва связи Al—Br в молекуле бромида алюминия составляет примерно 358 кДж/моль.
Вещество очень гигроскопично: на воздухе расплывается, легко поглощая влагу с образованием гексагидрата AlBr3•6H2O. Хорошо растворимо в воде, спирте, сероуглероде, ацетоне; плотность водного раствора при 20 °C составляет: 1079,2 кг/м³ (10%-ный раствор), 1172,5 кг/м³ (20%-ный раствор).
Химические свойства
- Безводный Бромид алюминия очень энергично реагирует с водой выделяя при растворении много тепла и, частично гидролизуясь:
- AlBr3 + 4 H2O ⇆ [Al(H2O)4]3+ + 3Br−
- [Al(H2O)4]3+ + H2O ⇆ [Al(H2O)3(OH)]2+ + H3O+
- При нагревании водного раствора гидролиз можно провести полностью:
- AlBr3 + 3 H2O = Al(OH)3 ↓ + 3 HBr ↑
- Вступает в реакцию со щелочами:
- При пропускании безводного сероводорода через раствор бромида алюминия в сероуглероде выпадает осадок комплексного соединения:
- AlBr3 + H2S = AlBr3 ⋅ H2S
- При высокой температуре разлагается:
- 2 AlBr3 = 2 Al + 3 Br2
- При нагревании бромида алюминия с алюминием в газовой фазе (1000 °C) образуется нестабильный монобромид алюминия:
- AlBr3 + 2 Al ⇆ 3 AlBr
- С гидридом лития образует алюмогидрид:
- AlBr3 + 4 LiH = Li[AlH4] + 3 LiBr
- Бромид алюминия — сильный акцептор электронных пар (кислота Льюиса) — легко присоединяет молекулы-доноры (на этом, в частности, основано его применение в органическом синтезе):
- AlBr3 + C2H5Br → [C2H5]+[AlBr4]−
Получение
Безводный Бромид алюминия получают взаимодействием простых веществ (Al и Br2):
2 Al + 3 Br2 = Al2Br6
Водный раствор можно получить реакцией алюминиевой стружки с бромоводородной кислотой:
2 Al + 6 HBr = 2 AlBr3 + 3 H2 ↑
Применение
Коммерческое применение бромида алюминия в настоящий момент относительно небольшое.
Бромид алюминия входит как основной компонент в состав ксилольных электролитов для электроосаждения алюминиевых покрытий.
Безводный Бромид алюминия используется в органическом синтезе, в частности, в реакции алкилирования по Фриделю-Крафтсу, по аналогии с хлоридом алюминия.
Соединение может выступать катализатором в реакции изомеризации бромалканов, например:
CH3−CH2−CH2Br →AlBr3 CH3−CHBr−CH3
Также Бромид алюминия может выступать в качестве бромирующего агента, например в реакции с хлороформом:
CHCl3 + HBr →90oC; AlBr3 CHBrCl2 + HCl
Опасность для здоровья
При контакте с кожей Бромид алюминия может вызывать ожоги.
Соединение умеренно ядовито: ЛД 50 (крысы) ≈ 1600 мг/кг (перорально); ЛД50 (крысы) ≈ 815 мг/кг (внутрибрюшинно).