Гидрид алюминия
Гидрид алюминия
| Гидрид алюминия | |
|---|---|
 |
|
| Систематическое наименование |
Гидрид алюминия |
| Традиционные названия | Гидрид алюминия, Гидрид алюминия III, алан |
| Хим. формула | (AlH3)n |
| Рац. формула | AlH3 |
| Состояние | твёрдое |
| Молярная масса | 30,005 г/моль |
| Плотность | 1,45 |
| Температура | |
| • разложения | 105 |
| Энтальпия | |
| • образования | − 12 кДж/моль |
| Рег. номер CAS | 7784-21-6 |
| PubChem | 14488 |
| Рег. номер EINECS | 232-053-2 |
| SMILES |
[AlH3]
|
| InChI |
1S/Al.3H
AZDRQVAHHNSJOQ-UHFFFAOYSA-N
|
| ChEBI | 30136 |
| ChemSpider | 13833 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Гидрид алюминия — AlH3, неорганическое бинарное соединение алюминия с водородом. В нормальных условиях — бесцветное или белое твёрдое вещество, имеющее полимерную структуру: (AlH3)n.
Впервые был получен в 1942 году действием тлеющего электрического разряда на смесь триметилалюминия и водорода.
Используется как компонент ракетного топлива, мощный восстановитель в органическом синтезе и в качестве катализатора для реакций полимеризации.
Содержание
Молекулярная структура
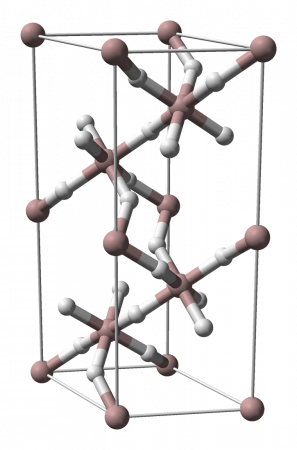
В обычных условиях Гидрид алюминия имеет полимерную молекулярную структуру (AlH3)n, при этом его кристаллическая форма существует в семи полиморфных модификациях: α-(AlH3)n, α1-(AlH3)n, β-(AlH3)n, δ-(AlH3)n, ε-(AlH3)n, γ-(AlH3)n, ζ-(AlH3)n.
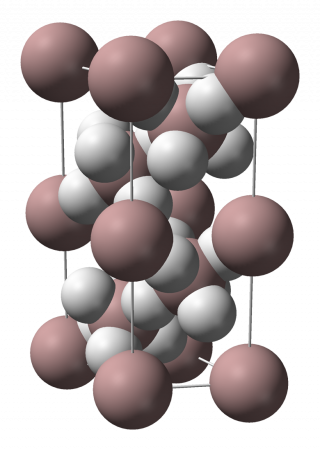
Самой устойчивой является модификация α-(AlH3)n, имеющая гексагональную сингонию (пространственная группа R3c, а = 4,449 Å, b = 4,449 Å, c = 11,804 Å). Длина связи Al—H составляет 1,72 Å, длина связи Al—Al: 3,24 Å. Структура α-(AlH3)n представляет собой совокупность октаэдров АlН6, объединенных шестью трехцентровыми двухэлектронными связями Аl—Н—Аl в кристаллический каркас.
Модификация γ-(AlH3)n существует в ромбической сингонии, пространственная группа Pnnm (а = 5,3806 Å, b = 7,3555 Å, c = 5,77509 Å). Ячейка кристаллической решётки гидрида состоит из двух октаэдров AlH6, длина связи Al—Al составляет 2,606 Å. Особенностью структуры является наличие разветвлённой двойной мостиковой связи Al—2H—Al (длина связи Al—H: 1,68—1,70 Å) в дополнение к обычной связи Al—H—Al (длина связи Al—H: 1,77—1,78 Å). Из-за наличия больших полостей в кристаллической структуре γ-(AlH3)n, данная модификация имеет плотность примерно на 11 % меньше, чем α-(AlH3)n.
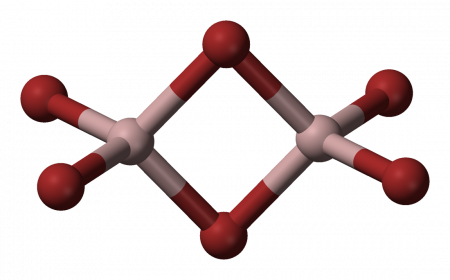
При взаимодействии распылённых лазером атомов алюминия с водородом при сверхнизких температурах (3,5 K) с последующим ультрафиолетовым излучением и нормализацией при 6,5 K, в продуктах фотолиза можно обнаружить структуры димера Al2H6, аналогичные структуре диборана B2H6. Димер (см. структуру на рисунке) очень неустойчив в конденсированном состоянии, поэтому его существование обнаружилось лишь спустя примерно пятьдесят лет после открытия гидрида алюминия.
В 2007 году группа учёных из США воздействовала на алюминий плазменным потоком атомов водорода и обнаружила, что в результате образуются различные анионные полиядерные гидриды алюминия, среди которых особый интерес вызвал анион Al4H6−, чей нейтральный гибрид Al4H6 по расчётам должен отличаться заметной стабильностью. Структурно соединение должно представлять искажённый тетраэдр с вершинами — атомами алюминия, в котором атомы водорода образуют четыре терминальные связи Al–H и две мостиковые связи Al–H–Al. Большой энергетический порог между высшими занятыми и низшими свободными молекулярными орбиталями в сочетании с исключительно высоким значением теплоты сгорания позволяют предположить, что этот Гидрид алюминия может представлять собой перспективный материал для ракетного топлива.
Физические свойства
Гидрид алюминия представляет собой твёрдое белое или бесцветное вещество. Плотность 1,45 (по другим данным 1,47) г/см³. Растворим в тетрагидрофуране (5 г в 100 г растворителя при 19,5 °C).
Термодинамические константы:
- стандартная энтальпия образования, ΔHo298: −12 кДж/моль (по другим данным: −11,43±0,84 кДж/моль);
- стандартная энтропия, So298: 30 Дж/(моль·K) (по другим данным: 30,06±0,42 Дж/(моль·K));
- стандартная энергия Гиббса, ΔGo298: 46 кДж/моль (по другим данным: 46,52±0,96 кДж/моль).
Большое содержание водорода в гидриде алюминия обуславливает ряд его свойств, связанных с проблемой высокотемпературной сверхпроводимости: в области давлений ~60 ГПа и температуре ~1000 K он обладает полупроводниковым механизмом проводимости, а в области высоких давлений и температур (до 90 ГПа и 2000 K) его проводимость сопоставима с металлической электропроводностью водорода.
Химические свойства
- Соединение нестабильно: при нагревании выше 100 °C разлагается:
- 2 AlH3 →to 2 Al + 3 H2
- Бурно взаимодействует с водой:
- AlH3 + 3 H2O → Al(OH)3 + 3 H2 ↑
- С диэтиловым эфиром образует высокореакционный, но относительно стабильный комплекс переменного состава, который часто используется для синтетических целей:
- AlH3 + n(C2H5)2O → AlH3 ⋅ n(C2H5)2O
- Аналогичный комплекс образуется с другими низшими алифатическими эфирами, а также с триметиламином: AlH3 • N(CH3)3. Последний взаимодействует с водой со взрывом.
- Для стабилизации гидрида алюминия также можно использовать комплексы с другими аминами, например с N-метилпирролидином (NMP): AlH3 • NMP и AlH3 • (NMP)2.
- Гидрид алюминия — очень сильный восстановитель. Он способен восстановить углекислый газ до метана:
- 4 AlH3 + 3 CO2 →to 3 CH4 + 2 Al2O3
- Известны многочисленные реакции восстановления органических соединений с использованием гидрида алюминия.
- Взаимодействует с гидридом лития, образуя алюмогидрид:
- AlH3 + LiH →(C2H5)2O LiAlH4
- Медленно вступает в реакцию с дибораном, образуя борогидрид алюминия (точнее Тетрагидридоборат алюминия):
- 2 AlH3 + B2H6 → 2 Al(BH4)3
Получение
Используемый сегодня принципиальный метод получения чистого гидрида алюминия из гидрида лития в среде диэтилового эфира был предложен ещё в 1947 году:
- AlCl3 + 4 LiH →(C2H5)2O LiAlH4 + 3 LiCl
- AlCl3 + 3 LiAlH4 →(C2H5)2O 4 AlH3 + 3 LiCl
Хлорид лития выпадает в осадок до момента полимеризации AlH3 и отделяется от эфирного раствора, из которого путём дальнейшей отгонки эфира получают комплекс гидрида алюминия с диэтиловым эфиром.
Также Гидрид алюминия по аналогии можно получить реакцией алюмогидрида лития с серной кислотой, хлоридом бериллия, хлоридом цинка, хлороводородом и алкилгалогенидами:
- 2 LiAlH4 + H2SO4 → 2 AlH3 + Li2SO4 + 2 H2
- 2 LiAlH4 + BeCl2 → 2 AlH3 + 2 LiCl + BeH2
- 2 LiAlH4 + ZnCl2 → 2 AlH3 + 2 LiCl + ZnH2
- LiAlH4 + R−CH2−Cl → AlH3 + LiCl + R−CH3
Вместо алюмогидрида лития можно использовать алюмогидрид натрия:
- AlCl3 + 3 NaAlH4 →(C2H5)2O 4 AlH3 + 3 NaCl
Для получения чистого гидрида (без примесей растворителя) эфирный комплекс подвергают нагреванию в вакууме с добавлением бензола или в присутствии небольших количеств LiAlH4 или смеси LiAlH4+LiBH4. При этом сперва получаются β-AlH3 и γ-AlH3 модификации, которые затем переходят в более стабильный α-AlH3.
Другим способом получения несольватированного эфиром гидрида алюминия, является электролиз алюмогидрида натрия в среде тетрагидрофурана.
Среди прочих методов отметим синтез с использованием гидрида магния:
- 2 AlCl3 + 3 MgH2 → 2 AlH3 + 3 MgCl2
Долгое время считалось, что Гидрид алюминия невозможно получить прямым взаимодействием элементов, поэтому для его синтеза использовали приведённые выше косвенные методы. Однако, в 1992 году группа российских учёных осуществила прямой синтез гидрида из водорода и алюминия, используя высокое давление (выше 2 ГПа) и температуру (более 800 K). Вследствие очень жёстких условий протекания реакции, в настоящий момент метод имеет лишь теоретическое значение.
Применение
Гидрид алюминия находит широкое применение в органическом синтезе в качестве сильнейшего восстанавливающего агента.
В связи с тем, что Гидрид алюминия представляет собой соединение с высоким содержанием водорода (10,1 %), он используется в производстве ракетных топлив и некоторых взрывчатых веществ, а также для систем хранения и генерации в автономных энергетических водородных установках.