Нитрат алюминия
Нитрат алюминия
| Нитрат алюминия | |
|---|---|
  |
|
| Систематическое наименование |
Нитрат алюминия |
| Традиционные названия | Азотнокислый алюминий, Нитрат алюминия, тринитрат алюминия, алюминия III нитрат |
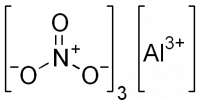
| Хим. формула | Al(NO3)3 |
| Рац. формула | Al(NO3)3 |
| Состояние | твёрдое |
| Молярная масса | 212,996 г/моль |
| Плотность | 1,89 |
| Температура | |
| • плавления | 66 °C (с разл.); нонагидрат: 73,5 |
| Энтальпия | |
| • образования | − 927 кДж/моль; нонагидрат: − 3757; гексагидрат: − 2871 кДж/моль |
| Растворимость | |
| • в воде | при 25 °C: 63,7 г/100 мл |
| • в воде | нонагидрат при 20 °C: 73,9 |
| • в в метаноле | при 35 °C: 14,45 |
| • в в этаноле | при 35 °C: 8,63 |
| • в в этиленгликоле | при 35 °C: 18,32 |
| Кристаллическая структура | моноклинная |
| Рег. номер CAS | 13473-90-0 7784-27-2 (нонагидрат) |
| PubChem | 16713320 |
| Рег. номер EINECS | 236-751-8 |
| SMILES |
[Al+3].O=[N+]([O-])[O-].[O-][N+]([O-])=O.[O-][N+]([O-])=O
|
| InChI |
1S/Al.3NO3/c;3*2-1(3)4/q+3;3*-1
JLDSOYXADOWAKB-UHFFFAOYSA-N
|
| RTECS | BD1040000 BD1050000 (нонагидрат) |
| ChemSpider | 24267 |
| ЛД50 | (крысы, перорально) 4280 мг/кг |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Нитрат алюминия, азотнокислый алюминий — Al(NO3)3, неорганическое соединение, алюминиевая соль азотной кислоты.
Помимо собственно безводного нитрата, у алюминия существуют и основные нитраты: AlOH(NO3)2 и Al(OH)2NO3, а также ряд гидратированных солей Al(NO3)3•xH2O (х = 4, 6, 8, 9), среди которых наиболее стабилен нонагидрат: Al(NO3)3•9H2O.
Содержание
Физические свойства
Безводный Нитрат алюминия представляет собой белое или бесцветное кристаллическое, чрезвычайно гигроскопичное вещество, дымящее на воздухе. Хорошо растворим в холодной воде (63,7 % при 25 °C) и полярных органических растворителях. Температура плавления 66 °C (с разложением), в вакууме возгоняется при 50 °C.
Нонагидрат Al(NO3)3•9H2O — белые кристаллы, расплывающееся на воздухе, с моноклинной структурой (a=1,086 нм, b=0,959 нм, c=1,383 нм, β=95,15°, z=4, пространственная группа P21/a). При нагревании чуть выше температуры плавления (73,6 °C) теряет сперва одну, а затем ещё две молекулы воды.
Плотность водного раствора нитрата алюминия при 18 °C:
| 16 % | 18 % | 20 % | 24 % | 28 % | 30 % | 32 % | — | |
|---|---|---|---|---|---|---|---|---|
| 1 % | 2 % | 4 % | 6 % | 8 % | 10 % | 12 % | 14 % | |
| Плотность, г/л | 1006,5 | 1014,4 | 1030,5 | 1046,9 | 1063,8 | 1081,1 | 1098,9 | 1117,1 |
| 1135,7 | 1154,9 | 1174,5 | 1215,3 | 1258,2 | 1280,5 | 1303,6 | — |
Химические свойства
- При растворении в воде подвергается гидролизу:
- Al(NO3)3 + 4 H2O ⇆ [Al(H2O)4]3+ + 3 NO3−
- [Al(H2O)4]3+ + H2O ⇆ [Al(H2O)3(OH)]2+ + H3O+
- Водные растворы нитрата алюминия имеют pH от 2,5 до 3,7.
- При нагревании гидролиз можно провести полностью:
- Al(NO3)3 + 3 H2O = Al(OH)3 ↓ + 3 HNO3 ↑
- Вступает в реакцию со щелочами:
- Al(NO3)3 + 3 NaOH = Al(OH)3 ↓ + 3 NaNO3
- Al(NO3)3 + 4 NaOH = Na[Al(OH)4] + 3 NaNO3
- Реакция с концентрированным водным раствором аммиака может идти по двум направлениям.
- На холоде:
- Al(NO3)3 + 3 NH3 + 3 H2O = Al(OH)3 ↓ + 3 NH4NO3
- При нагревании:
- Al(NO3)3 + 3 NH3 + 3 H2O = AlO(OH) ↓ + 3 NH4NO3 + H2O
- При нагревании разлагается:
- 4 Al(NO3)3 = 2 Al2O3 + 12 NO2 ↑ + 3 O2 ↑
- Нонагидрат при сильном нагревании (135 °C) сперва образует основную соль Al(OH)2NO3•1,5H2O, а при более высокой температуре (200 °C) разлагается до аморфного оксида алюминия.
- Нитрат алюминия является сильным окислителем — его безводная форма со взрывом реагирует со многими органическими растворителями (например: с диэтиловым эфиром и бензолом).
Получение
Лабораторные методы
В лаборатории водный раствор нитрата алюминия получают растворением алюминия в разбавленной азотной кислоте:
- 8 Al + 30 HNO3 = 8 Al(NO3)3 + 3 N2O ↑ + 15 H2O
Альтернативный метод заключается во взаимодействии гидроксида алюминия с азотной кислотой:
- Al(OH)3 + 3 HNO3 = Al(NO3)3 + 3 H2O
Наконец, искомую соль можно получить обменной реакцией сульфата алюминия с нитратом бария или свинца:
- Al2(SO4)3 + 3 Ba(NO3)2 = 2 Al(NO3)3 + 3 BaSO4 ↓
Из водного раствора посредством кристаллизации выделяют нонагидрат нитрата алюминия. Кристаллогидраты с меньшим количеством воды получают из водных растворов азотной кислоты.
Безводный Нитрат алюминия можно получить реакцией кристаллогидрата с избытком оксидом азота V (реакция (1)) или безводного хлорида алюминия с нитратом хлора (реакция (2)):
- Al(NO3)3 ⋅ 9 H2O + 9 N2O5 ⟶ Al(NO3)3+ 18 HNO3 (1)
- AlCl3 + 3 ClNO3 ⟶ Al(NO3)3 + 3 Cl2 (2)
Промышленное производство
В промышленности безводный Нитрат алюминия получают взаимодействием оксида или гидроксида алюминия с оксидом азота V:
- Al2O3 + 3 N2O5 ⟶ 2 Al(NO3)3
- Al(OH)3 + 3 N2O5 ⟶ Al(NO3)3 + 3 HNO3
В случае использования бромида алюминия в качестве исходного сырья для синтеза, реакция идёт в две стадии:
- 2 AlBr3 + 8 N2O5 = 2 [NO2]− [Al(NO3)4]+ + 3 Br2 + 6 NO2
- 2 [NO2]− [Al(NO3)4] = 2 Al(NO3)3 + 4 NO2 + O2
Применение
Соединение используется в текстильной промышленности как протрава при крашении тканей, для дубления кожи, в производстве нитей накаливания, в качестве катализатора при очистке нефти, антикоррозионного агента; в производстве изоляционных бумаг, нагревательных элементах, антиперспирантов; в ядерной физике.
Опасность
ЛД50 (крысы, перорально) = 4,28 г/кг.

