Карбонат кальция
карбонат кальция
| карбонат кальция | |||
|---|---|---|---|
|
|||
 |
|||
| Систематическое наименование |
карбонат кальция | ||
| Традиционные названия | углекислый кальций | ||
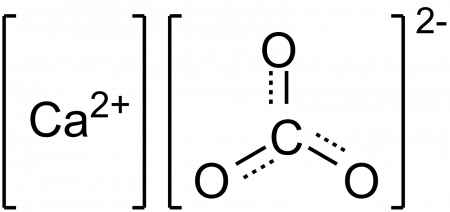
| Хим. формула | CaCO3 | ||
| Состояние | твёрдые белые кристаллы | ||
| Молярная масса | 100.0869 г/моль | ||
| Плотность | (кальцит) 2.74 г/см³ (арагонит) 2.83 г/см³ |
||
| Температура | |||
| • плавления | (кальцит) 825 °C, (арагонит) 1339 °C |
||
| • разложения | 900−1000 °C | ||
| Давление пара | 0 ± 1 мм рт.ст. | ||
| Константа диссоциации кислоты pKa | 9.0 | ||
| Растворимость | |||
| • в воде | (25 °C) 0,0014 г | ||
| Показатель преломления | 1,60 | ||
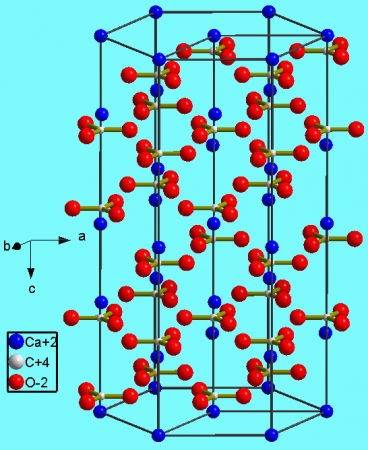
| Кристаллическая структура | тригональная, пространств. гр. 2/m | ||
| ГОСТ | ГОСТ 4530-76 | ||
| Рег. номер CAS | 471-34-1 | ||
| PubChem | 10112 | ||
| Рег. номер EINECS | 207-439-9 | ||
| SMILES |
C(=O)([O-])[O-].[Ca+2]
|
||
| InChI |
1S/CH2O3.Ca/c2-1(3)4;/h(H2,2,3,4);/q;+2/p-2
VTYYLEPIZMXCLO-UHFFFAOYSA-L
|
||
| Кодекс Алиментариус | E170 | ||
| RTECS | FF9335000 | ||
| ChEBI | 3311 | ||
| ChemSpider | 9708 | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
карбонат кальция (углекислый кальций) — неорганическое химическое соединение, соль угольной кислоты и кальция. Химическая формула CaCO3.
В природе встречается в виде многочисленных минералов, например, кальцита, арагонита и ватерита, является главной составной частью известняка, мрамора, мела, входит в состав скорлупы яиц птиц.
Нерастворим в воде и этаноле.
Зарегистрирован как белый пищевой краситель (E170).
Содержание
Применение
Используется как белый пищевой краситель E170. Являясь основой мела, используется для письма на досках. Используется в быту для побелки потолков, покраски стволов деревьев, для подщелачивания почвы в садоводстве.
Массовое производство/использование
Очищенный от примесей, карбонат кальция широко используется в бумажной и пищевой промышленности, в качестве наполнителя при производстве пластмасс, красок, резины, продукции бытовой химии, в строительстве.
При производстве бумаги карбонат кальция применяют одновременно в качестве отбеливателя, наполнителя, а также раскислителя.
Используется при производстве силикатного стекла, — материала для производства оконного стекла, стеклянных бутылок, стекловолокна.
Применяется при производстве предметов гигиены (например, зубной пасты), в медицине.
В пищевой промышленности часто используется в качестве препарата препятствующего слеживанию и для препятствования слипания в комки сухих молочных продуктах.
При употреблении сверх рекомендованной дозы (1,5 г в день) может вызывать молочно-щелочной синдром (синдром Бернетта). Рекомендован при болезнях костных тканей.
Производители пластмассы — одни из основных потребителей чистого карбоната кальция (более 50% всего потребления). Используемый в качестве наполнителя и красителя, карбонат кальция необходим при производстве поливинилхлорида (PVC), полиэфирных волокон (кримплен, лавсан, и т. п.), полиолефинов. Изделия из данных видов пластмасс распространены повсеместно — это трубы, сантехника, кафельная плитка, черепица, линолеум, ковровые покрытия, и т.п. карбонат кальция составляет порядка 20% красящего пигмента, используемого при производстве красок.
В строительстве
Строительство — ещё один из основных потребителей карбоната кальция. Например, в качестве наполнителя шпаклёвок и герметиков.
Также карбонат кальция является важным составным элементом при производстве продукции бытовой химии — средств для чистки сантехники, кремов для обуви.
карбонат кальция широко применяется для раскисления кислых почв.
Нахождение в природе
карбонат кальция находится в минералах в виде полиморфов:
- Арагонит
- Кальцит
- Фатерит (или μ-CaCO3)
Тригональная кристаллическая структура кальцита является наиболее распространенной.
Минералы карбоната кальция находятся в следующих горных породах:
- Мел
- Известняк
- Мрамор
- Травертин
- Доломит
Геология
Залежи карбоната кальция в виде меловых пластов — отложений известковых раковин моллюсков, в основном, мелового периода является распространенным минералом на всех континентах.
В природе встречаются три кристаллические модификации (минералы с одинаковым химическим составом, но с различной кристаллической структурой): кальцит, арагонит и фатерит (ватерит).
Некоторые горные породы (известняк, мел, мрамор, травертин и другие известковые туфы) практически полностью состоят из карбоната кальция с различными примесями.
Кальцит является устойчивой кристаллической модификацией карбоната кальция и встречается в самых разнообразных геологических условиях: в осадочных, метаморфических и магматических горных породах.
Около 10 % всех осадочных пород составляют известняки, сложенные преимущественно кальцитовыми остатками раковин морских организмов. Арагонит является второй по распространённости кристаллической модификацией CaCO3 и в основном формируется в раковинах моллюсков и скелетах некоторых других организмов.
Также арагонит может образовываться и в неорганических процессах, например в карстовых пещерах или гидротермальных источниках.
Фатерит является наименее стабильной разновидностью этого карбоната, и очень быстро превращается в воде либо в кальцит, либо в арагонит. В природе встречается относительно редко, когда его кристаллическая структура стабилизирована теми или иными примесями.
Получение
Подавляющее количество карбоната кальция, добывающееся из полезных ископаемых, используется в промышленности. Чистый карбонат кальция (например, для производства продуктов питания или использования в фармацевтических целях), может быть изготовлен из природного минерала с малым количеством вредных примесей, например, из мрамора.
В лаборатории карбонат кальция может быть приготовлен предварительным гашением оксида кальция — негашеной извести. При этом образуется гидроксид кальция, и затем в суспензию продувается углекислый газ для получения карбоната кальция:
- CaO + H2O ⟶ Ca(OH)2 ,
- Ca(OH)2 + CO2 ⟶ CaCO3 + H2O .
Химические свойства
При нагревании до 900—1000 °C разлагается на кислотный оксид — углекислый газ CO2 и основный оксид — негашёную известь CaO:
- CaCO3 ⟶ CaO + CO2↑ .
Растворяется в воде при избытке углекислого газа образуя кислую соль — Гидрокарбонат кальция Ca(HCO3)2:
- CaCO3 + CO2 + H2O ⟶ Ca(HCO3)2.
Из-за этой реакции образуются сталактиты, сталагмиты. Природные подземные воды, обильные углекислом газом, растворяют плохо растворимый карбонат кальция с образованием много лучше растворимого в воде гидрокарбоната кальция, при выделении подземной воды в виде капель с потолков пещер при попадании в воздух с низкой концентрацией углекислого газа происходит обратная реакция превращения гидрокарбоната кальция в плохо растворимый осадок карбоната кальция, образующего красивые природные формы в пещерах, и из-за этого же механизма образуются карстовые пещеры.
При обжиге с температурой свыше 1500 °C с углеродом, например, в форме кокса, образует карбид кальция и угарный газ:
- CaCO3 + 4C ⟶ CaC2 + 3CO↑