Ацетат кальция
Ацетат кальция
| Ацетат кальция | |
|---|---|
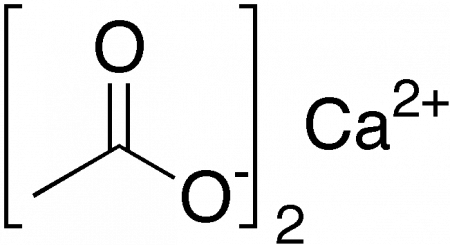 |
|
| Систематическое наименование |
Ацетат кальция |
| Сокращения | Ca(OAc)2 |
| Традиционные названия | Пригорело-древесная соль |
| Хим. формула | Ca(CH3CoO)2 |
| Рац. формула | CaC4H6O4 |
| Состояние | твёрдое |
| Молярная масса | 158.138 г/моль |
| Плотность | 1.6 г/см³ |
| Температура | |
| • плавления | 160 (с разложением) |
| • разложения | 160 ± 1 °C |
| Растворимость | |
| • в воде | 40 г/100 мл |
| Рег. номер CAS | 62-54-4 |
| PubChem | 6116 |
| Рег. номер EINECS | 200-540-9 |
| SMILES |
CC([O-)]=O.CC([O-])=O.[Ca++]
|
| InChI |
1S/2C2H4O2.Ca/c2*1-2(3)4;/h2*1H3,(H,3,4);/q;;+2/p-2
VSGNNIFQASZAOI-UHFFFAOYSA-L
|
| Кодекс Алиментариус | E263 |
| RTECS | AF7525000 |
| ChEBI | 3310 |
| ChemSpider | 5890 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Ацетат кальция — кальциевая соль уксусной кислоты. Бесцветное кристаллическое или аморфное вещество, хорошо растворимое в воде. Технический моногидрат может быть в форме гранул или некрупных игл. Обладает слабым вкусом и запахом уксуса. Химическая формула — Ca(CH3CoO)2, однако чаще получают его моногидрат Ca(CH3CoO)2•H2O.
Содержание

История названия
Пригорело-древесная соль — старинное название ацетата кальция — в старину получалась при сухой перегонке древесины, из-за чего древесина, естественно, обугливалась, «пригорала». Из-за того, что метод сухой перегонки древесины использовался алхимиками с незапамятных времён, установить человека, давшего такое название этой соли или впервые получившего её, невозможно.
Получение
В лаборатории получают действием уксусной кислоты на карбонат, оксид или гидроксид кальция.
-
- 2CH3COOH + CaCO3 → Ca(CH3CoO)2 + H2O + CO2↑
-
- 2CH3COOH + CaO → Ca(CH3CoO)2 + H2O
-
- 2CH3COOH + Ca(OH)2 → Ca(CH3CoO)2 + 2H2O
Применение
Не имеет промышленного применения.
Используется в лаборатории для получения диметилкетона (ацетона). Эту реакцию осуществляют, нагревая Ацетат кальция до 160 °С:
-
- Ca(CH3CoO)2 →160∘C CaCO3 + (CH3)2CO
Именно из-за этой реакции Ацетат кальция нельзя хранить или сушить вблизи открытого огня, а помещения, в которых происходят работы с ацетатом кальция, должны быть оборудованы приточно-вытяжной вентиляцией.
Также может применяться в лаборатории для получения сложных эфиров уксусной кислоты — алкилацетатов:
-
- Ca(CH3CoO)2 + 2CH3CH2Br → CaBr2 + 2CH3COOCH2CH3
Также Ацетат кальция используется для получения ацетата калия обменными реакциями из карбоната и/или бикарбоната калия:
Также Ацетат кальция применяют при получении лавсана в качестве катализатора.
Ещё одним способом применения ацетата кальция является приготовление аналога сухого спирта — твёрдого спиртового сольвата ацетата кальция — при смешивании ацетата кальция и этилового спирта.
Пищевая промышленность
Ацетат кальция зарегистрирован в пищевой промышленности в качестве пищевой добавки группы консервантов E263. Может применяться как консервант, регулятор кислотности, уплотнитель растительных тканей. Останавливает развитие болезнетворных бактерий в хлебобулочных изделиях, смягчает ярко выраженный кислый вкус консервированных овощей и фруктов. В сельскохозяйственной промышленности используется для консервации кормов. Так как действие ацетата кальция ограничено наличием в продуктах сульфатов, фосфатов, карбонатов и гидрокарбонатов, которые в конечном итоге дают осадки с катионом Ca2+, то применять его лучше в сочетании с другими консервантами.
| Массовая доля основного вещества,безводная форма, %, не менее | 98 |
| Потери при просушке, %, не более | 11 |
| pH 10%-го водного раствора | 6-9 (включительно) |
| Массовая доля нерастворимых веществ, %, не более | 0,3 |
Медицина
Ацетат кальция оказывает абсорбирующее действие на анионы фосфорных кислот:
Также Ацетат кальция восстанавливает положительный кальциевый баланс у больных с почечной недостаточностью в легкой, средней и тяжелой форме и у больных, находящихся на гемодиализе или перитонеальном диализе. Является безалюминиевым и безмагниевым фосфат-связывающим препаратом (фосфат-биндером). Фосфат-связывающая способность ацетата кальция в 2 раза выше, а всасываемость его в кишечнике значительно меньше, чем у кальция карбоната.
