Хлорид аммония
Хлорид аммония
| Систематическое наименование |
Хлорид аммония |
|---|---|
| Хим. формула | NH4Cl |
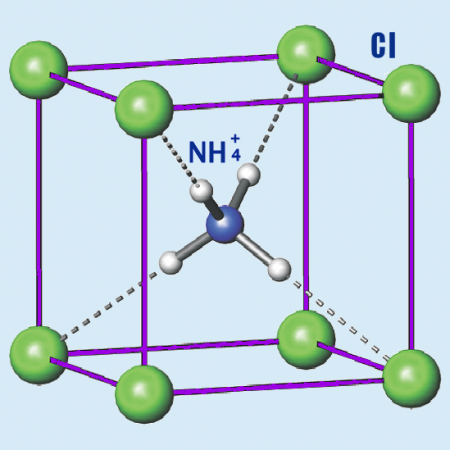
| Состояние | бесцветные кубические кристаллы |
| Молярная масса | 53,49 г/моль |
| Плотность | 1,527 г/см³ |
| Т. плав. | возгонка при 337,6 °C |
| Т. субл. | 662 ± 1 градус Фаренгейта |
| Энтальпия образования | -314,2 кДж/моль |
| Давление пара | 1 ± 1 мм рт.ст. |
| Растворимость в воде | (при 20 °C) 37,2 г/100 мл |
| Рег. номер CAS | ГОСТ 3773-72 ГОСТ 2210-73 |
| Рег. номер CAS | [12125-02-9] |
| PubChem | 25517 |
| Рег. номер EINECS | 235-186-4 |
| SMILES |
N.Cl
|
| InChI |
1S/ClH.H3N/h1H;1H3
NLXLAEXVIDQMFP-UHFFFAOYSA-N
|
| Кодекс Алиментариус | E510 |
| RTECS | BP4550000 |
| ChEBI | 31206 |
| ChemSpider | 23807 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Хлорид аммония (хлористый аммоний; техническое название — нашатырь; NH4Cl) — соль аммония, белый кристаллический слегка гигроскопичный порошок без запаха.
Содержание
Физические свойства
Бесцветные или белые кубические кристаллы. Растворимость (безводного вещества в безводном растворителе): в этаноле — 0,6 г/100 г, в метаноле — 3,3 г/100 г. Водные растворы вследствие гидролиза имеют слабокислую реакцию; хорошо растворим в жидком аммиаке.
| 0 °C | 10 °C | 20 °C | 30 °C | 40 °C | 50 °C | 60 °C | 70 °C | 80 °C | 90 °C | 100 °C |
|---|---|---|---|---|---|---|---|---|---|---|
| 29,4 | 33,3 | 37,2 | 41,4 | 45,8 | 50,4 | 55,2 | 60,2 | 65,6 | 71,3 | 77,3 |
При нагревании до 338 °C полностью распадается на NH3 и HCl (возгонка).
Химические свойства
- реагирует с щелочами с выделением аммиака:
- реагирует с нитратом серебра с выпадением белого осадка хлорида серебра, темнеющего при действии света:
-
- NH4Cl + AgNO3 → AgCl↓ + NH4NO3
- реагирует с нитритом натрия при нагревании, с образованием хлорида натрия, азота и воды:
-
- NH4Cl + NaNO2 → NaCl + N2↑ + 2H2O
- под действием электрического тока разлагается с образованием хлористого азота NCl3

Получение
В промышленности Хлорид аммония получают упариванием маточного раствора, остающегося после отделения гидрокарбоната натрия NaHCO3 после реакции, в которой углекислый газ пропускают через раствор аммиака и хлорида натрия.
-
- NH3 + H2O + CO2 + NaCl → NaHCO3 + NH4Cl
В лаборатории Хлорид аммония получают взаимодействием хлороводорода с аммиаком при пропускании их через раствор NaCl.
Иногда используют реакцию взаимодействия аммиака с хлором:
-
- 8NH3 + 3Cl2 → N2 + 6NH4Cl
Реакция взаимодействия аммиака и соляной кислоты:
-
- NH3 + HCl → NH4Cl
Применение
- азотное удобрение (до 25 % N) для нейтральных и щелочных почв под культуры, слабо реагирующие на избыток хлора (сахарная свёкла, рис, кукуруза);
- зарегистрирован в качестве пищевой добавки E510, в скандинавских странах и Финляндии применяется как пищевая приправа, в том числе в составе лакричных конфет «Tyrkisk Peber» «Salmiakki» и т. д.;
- используют при пайке как флюс (для удаления оксидной плёнки с поверхностей металлов);
- в гальванических элементах как компонент электролита;
- в медицине при отёках сердечного происхождения и для усиления действия диуретиков;
- в лабораторных технологиях — для лизиса эритроцитов
- как дымообразователь;
- в фотографии как компонент быстрого фиксажа, для получения тиосульфата аммония непосредственно в растворе.