Нитрат кальция
нитрат кальция ГОСТ 4142-77
| нитрат кальция | |
|---|---|
 |
|
 |
|
 |
|
| Традиционные названия | кальциевая селитра, норвежская селитра, азотнокислый кальций |
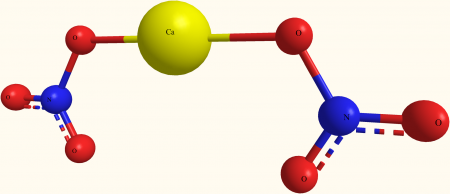
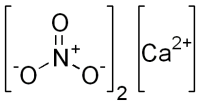
| Хим. формула | Ca(NO3)2 |
| Состояние | гранулы сферической формы белого, светло-серого, светло-бежевого цвета |
| Молярная масса |
(безводная) 164,088 г/моль; (тетрагидрат) 236,15 г/моль |
| Плотность |
(безводная) 2,504 г/см³; (тетрагидрат) 1,896 г/см³ |
| Т. плав. |
(безводная) 561 °C; (тетрагидрат) 42,7 °C |
| Т. кип. |
(безводная) разлагается; (тетрагидрат) 132 °C |
| Т. всп. | негорючая °C |
| Мол. теплоёмк. | 149,33 Дж/(моль·К) |
| Энтальпия образования | -937,2 кДж/моль |
| Растворимость в воде |
Безводной: 121,2 г/100 мл (20 °C); 271,0 г/100 мл (40 °C); 359 г/100 мл (51,6 °C). Тетрагидрата: 102 г/100 мл (0 °C); 129 г/100 мл (20 °C); (100 °C) 363 г/100 мл |
| Растворимость в | спирте и ацетоне |
| Кристаллическая структура |
кубическая (безводная) моноклинная (тетрагидрат) |
| Рег. номер CAS |
10124-37-5 (безводная) 13477-34-4 (тетрагидрат) |
| PubChem | 24963 |
| Рег. номер EINECS | 233-332-1 |
| SMILES |
[Ca+2].[O-][N+]([O-])=O.[O-][N+]([O-])=O
|
| InChI |
1S/Ca.2NO3/c;2*2-1(3)4/q+2;2*-1
ZCCIPPOKBCJFDN-UHFFFAOYSA-N
|
| RTECS | EW2985000 |
| ChEBI | 64205 |
| Номер ООН | 1454 |
| ChemSpider | 23336 и 21500286 |
| ГОСТ | ГОСТ 4142-77 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Кальция нитрат (кальциевая селитра, азотнокислый кальций) — неорганическая соль азотной кислоты. Соединение сильно гигроскопично, поэтому его хранят без доступа влаги. Химическая формула Ca(NO3)2.
Свойства
Физические свойства
Химические свойства
При 500 °C начинает разлагаться с выделением O2 и образованием сначала Ca(NO2)2, а затем CaO и NO2. Кальциевая селитра при нормальных условиях негорючая, пожаро- и взрывобезопасная, устойчивая в интервале температур от −60 °C до +155 °C.
Получение
Получают кальция нитрат действием HNO3 на известняк или поглощением нитрозных газов (в основном NO2) известковым молоком. Применяют кальция нитрат как азотное удобрение и для получения особо чистого CaO.
Для получения гранулированной кальциевой селитры используется способ низкотемпературной нейтрализации азотной кислоты природным известняком или продуктами переработки известняка.

Реакции с получением нитрата кальция
нитрат кальция производится путём обработки известняка с азотной кислотой, после нейтрализации аммиака:
- CaCO3 + 2HNO3 → Ca(NO3)2 + CO2 + H2O.
Он также является побочным продуктом процесса Оддо при добыче фосфата кальция:
- Ca3(PO4)2 + 6HNO3 → 2H3PO4 + 3Ca(NO3)2.
Так же как нитраты других щелочноземельных металлов и LiNO3, кальциевая селитра при нагревании разлагается на выпуске диоксида азота:
- 2Ca(NO3)2 → 2CaO + 4NO2 + O2, ΔH°обр.=369 кДж/моль
Также нитрат кальция можно получить проделав следующие реакции:
- 4Ca + 10HNO3 ⟶ 4Ca(NO3)2 + N2O + 5H2O
- CaO + 2HNO3 ⟶ Ca(NO3)2 + H2O
- Ca(OH)2 + 2HNO3 ⟶ Ca(NO3)2 + 2H2O
- CaCl2 + 2AgNO3 ⟶ Ca(NO3)2 + 2AgCl
- 3Ca + 8HNO3 ⟶ 3Ca(NO3)2 + 2NO + 4H2O
- 2Ca(OH)2 + 4NO2 ⟶ Ca(NO3)2 + Ca(NO2)2 + 2H2O
- 3Ca(NO2)2 + 4HNO3 ⟶ 3Ca(NO3)2 + 2H2O + 4NO
- Ca5(PO4)3F + 10HNO3 ⟶ 3H3PO4 + 5Ca(NO3)2 + HF
- CaF2 + 2HNO3 ⟶ Ca(NO3)2 + 2HF
- 2Ca5(PO4)3F + 14HNO3 ⟶ 3Ca(H2PO4)2 + 7Ca(NO3)2 + 2HF
- Ca5(PO4)3F + 4HNO3 ⟶ 3CaHPO4 + 2Ca(NO3)2 + HF
- 2NH4NO3 + Ca(OH)2 ⟶ Ca(NO3)2 + 2H2O + 2NH3
- Ca(PH2O2)2 + 2H2O + 4AgNO3 ⟶ 4Ag↓ + 2H2(PHO3) + Ca(NO3)2 + 2HNO3
- CaS + 4HNO3(конц.) ⟶ Ca(NO3)2 + S↓ + 2NO2↑ + 2H2O
- CaHPO4 + 2HNO3(конц.) ⟶ Ca(NO3)2 + H3PO4
- Ca(NO3)2 ⋅ 4H2O →60−100oC Ca(NO3)2 + 4H2O
Также образование нитрата кальция возможно и за счет атмосферных явлений:
- N2 + 2O2 ⟶ 2NO2 (грозовой разряд)
- 2NO2 + H2O ⟶ HNO2 + HNO3
- 2HNO3 + Ca2+ ⟶ Ca(NO3)2 + 2H+
- 2NO2 + H2O ⟶ HNO2 + HNO3


Применение
Гранулированный, безводный нитрат кальция, применяется как добавка в бетон, в качестве удобрения, для приготовления рассола в холодильной технике, в производстве реактивов, стеклопластиков, а также как один из компонентов для производства взрывчатки.
В сельском хозяйстве
нитрат кальция является физиологическим щелочным удобрением, пригодным для всех почв и прежде всего для закисленных почв. В сельском хозяйстве применяют как азотное удобрение. Выпускают в гранулированном виде; товарный продукт должен содержать не менее 15,5 % азота, кроме того, к нему добавляют в процессе производства 4—7 % нитрата аммония для уменьшения гигроскопичности удобрения; содержание влаги не должно превышать 15 %. нитрат кальция вносят под все культуры. Наиболее эффективен на кислых почвах, особенно для весенней подкормки озимых.
В пиротехнике
Несмотря на то, что нитрат кальция в смеси с горючими веществами способен давать недорогой источник кирпично-красного пламени, применение его в этом качестве крайне ограничено из-за сильной гигроскопичности.

