Фторид кальция
Фторид кальция
| Фторид кальция | |
|---|---|
 |
|
 |
|
| Систематическое наименование |
Фторид кальция |
| Традиционные названия | Фтористый кальций, кальция дифторид, Плавиковый шпат, флюорит |
| Хим. формула | CaF2 |
| Рац. формула | CaF2 |
| Состояние | белое кристаллическое вещество (монокристаллы являются прозрачными) |
| Молярная масса | 78,07 г/моль |
| Плотность | 3,18 г/см³ |
| Температура | |
| • плавления | 1418 °C |
| • кипения | 2533 °C |
| • вспышки | негорюч °C |
| Мол. теплоёмк. | 67,03 Дж/(моль·К) |
| Энтальпия | |
| • образования | -1221 кДж/моль |
| Удельная теплота плавления | 30 Дж/кг |
| Константа диссоциации кислоты pKa | 1 |
| Растворимость | |
| • в воде | (18 °C) 0,0015 г/100мл (20 °C) 0,0016 г/100 мл |
| • в ацетоне | нерастворим |
| Показатель преломления | 1,4328 |
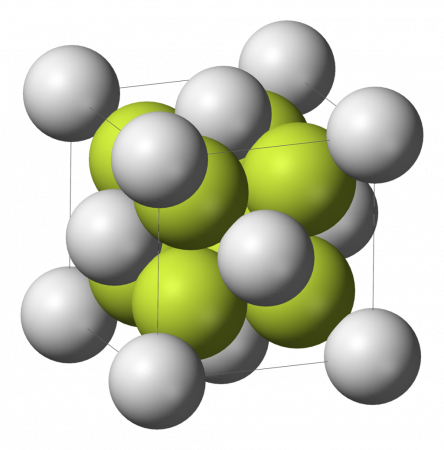
| Кристаллическая структура | кубическая кристаллическая структура |
| Рег. номер CAS | 7789-75-5 |
| PubChem | 24617 |
| Рег. номер EINECS | 232-188-7 |
| SMILES |
[Ca+2].[F-].[F-]
|
| InChI |
1S/Ca.2FH/h;2*1H/q+2;;/p-2
WUKWITHWXAAZEY-UHFFFAOYSA-L
|
| RTECS | EW1760000 |
| ChEBI | 35437 |
| ChemSpider | 23019 |
| ЛД50 | (перорально, крысы) 4250 мг/кг |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Фторид кальция — неорганическое бинарное ионное химическое соединение. Химическая формула CaF2.
Содержание

Физические свойства
Бесцветные диамагнитные кристаллы (в измельчённом состоянии — белые). До температуры 1151 °C существует α-CaF2 с кубической решеткой (а = 0,54626 нм, z=4, пространственная группа Fm3m), выше 1151 °C — разупорядоченная модификация тетрагональной сингонии, температура плавления у этой модификации — 1418 °C.
Плохо растворим в воде (16 мг/л при 18 °C).
Получение
В природе CaF2 встречается в виде минерала флюорита (Плавиковый шпат), который содержит до 90-95 % CaF2 и 3,5-8 % SiO2. Это хрупкий и мягкий минерал с большой вариацией в цвете: бесцветный, белый, жёлтый, оранжевый, красный, бурый, зелёный, зеленовато-голубой, фиолетово-синий, серый, пурпурный, синевато-чёрный, розовый и малиновый. Окраска связана с примесями хлора, железа, урана, дефектами кристаллической структуры, которая весьма тонко реагирует на нагревание. Является основным источником фтора в мире. Мировое производство ~4,5 млн т/год (1983 год).
В лабораторных условиях Фторид кальция обычно получают из карбоната кальция и плавиковой кислоты:
- CaCO3 + 2HF → CaF2↓ + CO2↑ + H2O
Чисто теоретический интерес представляет способ получения непосредственно из простых веществ:
- Ca + F2 → CaF2
Разбавленная плавиковая кислота взаимодействует с оксидом кальция:
- CaO + 2HF → CaF2↓ + H2O
Фторид кальция можно получить обменными реакциями, например:
- CaCl2 + 2NH4F → CaF2↓ + 2NH4Cl

Химические свойства
Фторид кальция химически относительно пассивен. При высокой температуре подвергается гидролизу:
- CaF2 + H2O →800oC CaO + 2HF
- CaF2 + H2O + SiO2 →1450oC CaSiO3 + 2HF
Разлагается концентрированной серной кислотой, что используется в промышленности для получения HF:
- CaF2 + H2SO4 →130−200oC CaSO4 + 2HF↑
При избытке HF образует сложный кристаллогидрат:
- CaF2 + 2HF + 6H2O → Ca(HF2)2 ⋅ 6H2O↓
При температуре в 600—700 °C Фторид лития реагирует с оксидом кальция, давая на выходе Оксид лития и Фторид кальция:
- 2LiF + CaO →600−700oC CaF2 + Li2O
Фторид лития с насыщенным раствором гидроксида кальция реагирует образовывая гидроксид лития и Фторид кальция:
- 2LiF + Ca(OH)2 → CaF2 + 2LiOH
Применение
Фторид кальция является основным источником фтора и его соединений. Начиная с конца 1990-х годов добывалось ~5 млн тонн данного вещества в год.
Фторид кальция является компонентом металлургических флюсов, специальных стекол, эмалей, керамики, оптических и лазерных материалов. Он также используется в качестве флюса при плавке и переработке жидких чугуна и стали.
В лаборатории Фторид кальция широко применяется в качестве оптического материала для инфракрасного и ультрафиолетового излучений, а также как материал с чрезвычайно низким показателем преломления. В первые годы 21-го века цена на рынке фторида кальция упала, и многие крупные заводы были закрыты. Canon и другие производители используют синтетически выращенные кристаллы фторида кальция в качестве компонентов в объективах, уменьшающих рассеивание света.
Применяется в стоматологии, для глубокого фторирования – насыщения твердых тканей зуба минеральными соединениями, путём обработки(очистка, просушивание струёй воздуха зуба и нанесение) поврежденных мест. Благодаря этому, терапевтический эффект по сравнению с применением фторлаков, усиливается в 100 раз.
Отличные механические, технические и эксплуатационные характеристики в сочетании с прозрачностью в широком спектральном диапазоне, высокой оптической однородностью, высокой радиационной устойчивостью позволяют использовать оптические монокристаллы фторида кальция в:
- Микроскопии,
- Квантовой и силовой оптике,
- Инфракрасной технике,
- Спектрофотометрии,
- Фурье-спектроскопии,
- Рентгеновской технике,
- Космотехнике,
- Астрономии,
- Голографии.
Монокристаллы используются для изготовления окон, призм, линз и других оптических деталей, работающих в диапазоне излучения от ультрафиолетового до инфракрасного. Оптические детали из фторида кальция используются без защитных покрытий.
Опасность применения
Фторид кальция считается относительно безвредным в силу его малой растворимости в воде. Ситуация схожа и с BaSO4, где токсичность, обычно связанная с Ba2+, компенсируется очень низкой растворимостью сульфата.
