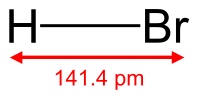
Бромоводород
бромоводород
| бромоводород | |||
|---|---|---|---|
|
|||
| Систематическое наименование |
бромоводород | ||
| Традиционные названия | бромистый водород | ||
| Хим. формула | HBr | ||
| Рац. формула | HBr | ||
| Состояние | бесцветный газ | ||
| Молярная масса | 80,91 г/моль | ||
| Плотность | газ (25 °C), 3,307 г/л, жидкий (−68 °C) 2,17 г/см³ | ||
| Энергия ионизации | 11,62 ± 0,01 эВ | ||
| Температура | |||
| • плавления | –86.80 °C | ||
| • кипения | –66.38 °C | ||
| Критическая точка | 90,0 °C, 8,54 МПа | ||
| Энтальпия | |||
| • образования | -34,1 кДж/моль | ||
| Давление пара | 20 ± 1 атм, 20,003 бар, 26,5 бар и 40,7 бар | ||
| Константа диссоциации кислоты pKa | ≈ –9 | ||
| Растворимость | |||
| • в воде | 193 (20 °C) | ||
| Дипольный момент | 0,24 Д | ||
| Рег. номер CAS | 10035-10-6 | ||
| PubChem | 260 | ||
| Рег. номер EINECS | 233-113-0 | ||
| SMILES |
Br
|
||
| InChI |
1S/BrH/h1H
CPELXLSAUQHCOX-UHFFFAOYSA-N
|
||
| RTECS | MW3850000 | ||
| ChEBI | 47266 | ||
| Номер ООН | 1048 | ||
| ChemSpider | 255 | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
бромоводород (HBr) — соединение брома с водородом. Бесцветный тяжёлый токсичный газ, образует туман в сыром воздухе.
Содержание
- 1 Получение
- 2 Физические свойства
- 3 Химические свойства
- 4 Применение
- 5 Транспортировка
- 6 Токсичность

Получение
В промышленности бромоводород получают непосредственным взаимодействием простых веществ:
- H2 + Br2 →200−400oC,Pt2 HBr
Также бромистый водород получается как побочный продукт при синтезе бромпроизводных органических соединений
В лаборатории получают гидролизом трибромида или пентабромида фосфора:
- PBr3 + 3H2O ⟶ H3PO3 + 3HBr
- PBr5 + 4H2O ⟶ H3PO4 + 5HBr
Восстановление брома несколькими способами:
- 3Br2 + S + 4H2O →100−150oC H2SO4 + 6HBr
- Br2 + KNO2 + H2O → KNO3 + 2HBr
Вытеснение из бромидов щелочных металлов разбавленной кислотой:
- KBr + H2SO4 →H2O KHSO4 + HBr↑
Физические свойства
бромистый водород - это бесцветный ядовитый газ с резким запахом, сильно дымящий на воздухе. Термически очень устойчив.
Хорошо растворим в воде: 221 г/100 г воды при 0 °C (193 при 25°, 130 при 100 °C). Водный раствор образует азеотропную смесь с 47,63 % HBr, которая кипит при 124,3 °C.
Растворяется в этаноле, образуя слабый электролит.
При охлаждении водных растворов HBr можно получить кристаллогидраты:
- HBr·H2O — устойчив при −15,5÷-3,3 °C
- HBr·2H2O — плавится при −11,2 °C
- HBr·4H2O — плавится при −55,8 °C
Чистый HBr образует кристаллы орторомбической сингонии, пространственная группа F mmm, параметры при −173 °C a = 0,5640 нм, b = 0,6063 нм, c = 0,5555 нм, Z = 4.
Химические свойства
Водный раствор бромистого водорода образует сильную одноосновную кислоту:
- HBr + H2O ⇄ Br− + H3O + pK =−9
Термически HBr очень устойчив, при температуре 1000 °C разлагаются около 0,5 % молекул:
- 2HBr ⇄ H2 + Br2
Как кислота реагирует с металлами, их оксидами, основаниями:
- 2HBr + Mg → MgBr2 + H2↑
- 2HBr + CaO → CaBr2 + H2O
- 2HBr + Ba(OH)2 → BaBr2 + 2H2O
Является восстановителем, медленно окисляется на воздухе, из-за чего водные растворы со временем окрашиваются в бурый цвет:
- 4HBr + O2 →τoC 2Br2 + 2H2O
Применение
Применяют для приготовления бромидов, синтеза различных органических бромпроизводных и для реактивного ионного травления.
Транспортировка
Безводный HBr транспортируют в баллонах ёмкостью 6,8 и 68 кг под давлением 24 атм.
Токсичность

бромистый водород — едкое, весьма токсичное вещество, обладающее удушающим действием. Предельно допустимая концентрация = 10 мг/м³, поражающая токсодоза = 2,4 мг/л·мин.