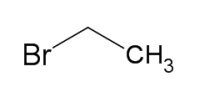
Бромэтан
Бромэтан
Бромэтан (бромистый этил, этилбромид) C2H5Br — прозрачная бесцветная или слегка желтоватая токсичная жидкость с запахом хлороформа.
Содержание
Получение
При промышленном производстве бромистый этил получают из этилена:
- CH2 = CH2 + HBr → CH3−CH2−Br
В лабораторных условиях бромэтил получают действием бромоводорода на Этанол. Чаще всего бромоводород получают in situ из бромида калия и серной кислоты:
Другие лабораторные способы:
- CH3CH2−OH + PBr3 → CH3CH2−Br + P(OH)3
- CH3CH2−OH + PBr5 → CH3CH2−Br + PO(OH)3 + HBr
Способы получения, редко используемые на практике:
- CH3−CH3 + Br2 →hν CH3CH2−Br + H B r
- CH3CH2−COOAg + Br2 → CH3CH2−Br + CO2 + AgBr
Физические свойства
Бромэтил — прозрачная бесцветная или слегка желтоватая жидкость с запахом хлороформа. Под действием света и воздуха (кислорода) легко разлагается, поэтому его следует хранить в герметически закупоренных темных склянках.
Химические свойства
В воде, как и многие галогенопроизводные, медленно гидролизуется:
- CH3CH2Br + H2O ⇌ CH3CH2−OH + HBr
С водными щелочами взаимодействие идёт быстрее и двумя путями:
Применение
Применяется в медицинской промышленности, в производстве этиловой жидкости, как химсырье органического синтеза, а также в качестве рабочего вещества или компонента в автоматических системах пожаротушения, наркотик с узким терапевтическим диапазоном, вызывает повреждение миокарда.
Токсичность
Бромэтан в больших количествах весьма токсичен. При остром отравлении наблюдаются наркотическое состояние, тахикардия, цианоз, коллапс. ЛК50: 36 мг/л (белые мыши, экспозиция 2 ч.), 53 мг/л (белые крысы, экспозиция 4 ч.).