Сульфат серебра
Сульфат серебра
| Сульфат серебра | |
|---|---|
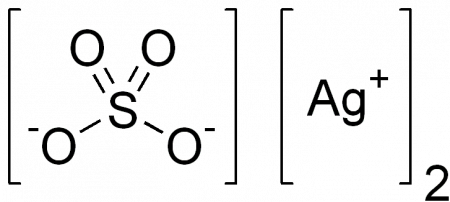 |
|
| Систематическое название | Сульфат серебра I |
| Химическая формула | Ag2SO4 |
| Внешний вид | белые кристаллы |
| Молярная масса | 311,8 г/моль |
| Температура плавления | 660 °C (933,15 К) |
| Температура разложения | 750—1100 °C |
| Фазовые переходы | 427 °C (ромб. → гекс.) |
| Плотность | 5,45 г/см³ |
| Растворимость в воде | 0,79 г/100 мл |
| LD50 | 5000 мг/кг |
| Кристаллическая решётка | Орторомбическая |
| Стандартная энтальпия образования | −715 кДж/моль |
| Энтальпия плавления | +16,74 кДж/моль |
| Стандартная молярная энтропия | +200 Дж/(К·моль) |
| Стандартная энергия образования Гиббса | −618 кДж/моль |
| Регистрационный номер CAS | 10294-26-5 |
| Регистрационный номер EC | 233-653-7 |
| R-фразы | R41 |
| S-фразы | S22; S26; S39 |
| H-фразы | H318 |
| P-фразы | P260; P280; P305 + P351 + P338; P313 |
| Пиктограммы опасности |  |
| Пиктограммы опасности СГС |  |
| Где это не указано, данные приведены при стандартных условиях (25 °C, 100 кПа). | |
Сульфат серебра (Сульфат серебра I) — неорганическое вещество с формулой Ag2SO4, соль серебра в степени окисления +1 и серной кислоты.
Бесцветные кристаллы со временем темнеющие от воздействия света. Плохо растворим в воде.
Применяется в качестве стандартного вещества для тепловой калибровки калориметров и иногда для бактерицидной обработки воды.
Содержание

Физические свойства
При нормальных условиях Сульфат серебра — белое кристаллическое вещество, малорастворимое в воде (0,79 г/100 г H2O при 20 °C; 1,30 г/100 г H2O при 80 °C), нерастворимое в этаноле. При осаждении из водных растворов не образует кристаллогидратов.
Существует в двух кристаллических модификациях: с ромбической и гексагональной сингонией кристаллической решётки. Температура фазового перехода из ромбической формы в гексагональную — 427 °C.
При 660 °C плавится без разложения.
Химические свойства
Окислительно-восстановительные реакции
При температуре 750−1100 °C Сульфат серебра разлагается с выделением металлического серебра:
- Ag2SO4 ⟶ 2 Ag + SO2 + O2
Также металлическое серебро восстанавливается из сульфата при нагревании последнего в токе водорода выше 200 °C:
- Ag2SO4 + H2 ⟶ 2 Ag + H2SO4
или при нагревании с сульфидом серебра выше 300 °C:
- Ag2SO4 + Ag2S ⟶ 4 Ag + 2 SO2
Обменные реакции
Сульфат серебра растворяется в концентрированном водном растворе аммиака с образованием комплекса:
- Ag2SO4 + 4 (NH3 ⋅ H2O) ⟶ [Ag(NH3)2]2SO4 + 4 H2O
При небольшом (до 50 °C) нагревании Сульфат серебра растворяется в концентрированной серной кислоте с образованием гидросульфата серебра:
- Ag2SO4 + H2SO4 ⟶ 2 AgHSO4
При взаимодействии с концентрированной соляной кислотой выпадает осадок хлорида серебра:
При взаимодействии с концентрированной щёлочью выпадает осадок оксида серебра (I):
- Ag2SO4 + 2 KOH ⟶ K2SO4 + Ag2O ↓ + H2O
Получение
Сульфат серебра может быть получен нагреванием металлического серебра с диоксидом серы и кислородом выше 450 °C:
- 2 Ag + SO2 + O2 ⟶ Ag2SO4
Взаимодействием металлического серебра с горячей концентрированной серной кислотой:
- 2 Ag + 2 H2SO4 ⟶ Ag2SO4 ↓ + SO2 ↑ + 2 H2O
Осаждением из растворов в реакциях ионного обмена, например:
- 2 AgNO3 + Na2SO4 ⟶ Ag2SO4 ↓ + 2 NaNO3
Вытеснением концентрированной серной кислотой летучих соединений водорода из солей:
- 2 AgX + H2SO4 ⟶ Ag2SO4 ↓ + 2 HX ↑ , где X = F, Br, I, CN.

Применение
Применяется для бактерицидной обработки воды.
Калориметрия
Сульфат серебра используется как химический стандарт для калибровки калориметров по температуре и теплоемкости.
Физиологическое действие
Сульфат серебра оказывает сильное раздражающее действие на глаза. При длительном контакте с кожей может вызывать аргирию.
LD50 5000 мг/кг.

