Йодид меди (I)
Йодид меди (I)
| Йодид меди (I) | |
|---|---|
 |
|
| Систематическое название | Йодид меди (I) |
| Химическая формула | CuI |
| Внешний вид | белые кристаллы, со временем коричневеют |
| Молярная масса | 190,45 г/моль |
| Температура плавления | 605 °C (878,15 К) |
| Температура кипения | 1320 °C (1593,15 К) |
| Плотность | 5,62 г/см³ |
| Показатель преломления | 2,346 |
| Твёрдость по Моосу | 2,5 |
| Растворимость в воде | 2⋅10−5 г/100 мл |
| Произведение растворимости | 1,1⋅10−12 |
| Давление пара | 13 гПа (656 °С) |
| Стандартная энтальпия образования | −68 кДж/моль |
| Стандартная молярная энтропия | +97 Дж/(моль·К) |
| Стандартная энергия образования Гиббса | −70 кДж/моль |
| Регистрационный номер CAS | 7681-65-4 |
| Регистрационный номер EC |
231-674-6 |
| H-фразы | H302; H315; H319; H335; H340 |
| P-фразы | P261; P273; P305 + P351 + P338 |
| Пиктограммы опасности |   |
| Пиктограммы опасности СГС |   |
| Где это не указано, данные приведены при стандартных условиях (25 °C, 100 кПа). | |
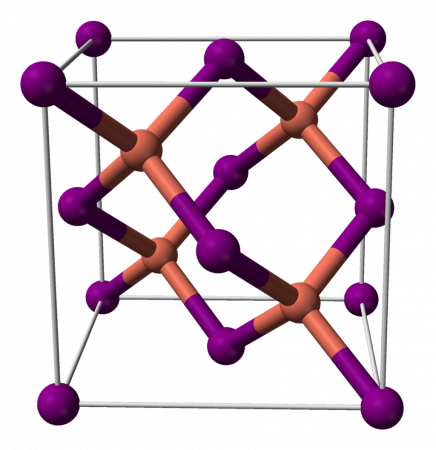
Йодид меди (I) — неорганическое вещество с формулой CuI, соединение меди и йода. Относится к классу бинарных соединений, может рассматриваться как соль одновалентной меди и йодоводородной кислоты. В чистом виде — белое кристаллическое вещество, со временем приобретает бурый цвет из-за разложения на медь и йод.
Содержание
Нахождение в природе
Йодид меди (I) встречается в природе в виде минерала маршита. Цвет минерала от белого до темно-коричневого. Твёрдость по шкале Мооса 2,5.
Физические свойства
Йодид меди (I) при нормальных условиях — твёрдое вещество белого цвета, нерастворимое в воде, этаноле, эфире, хорошо растворимое в пиридине (до 1,73 моль/кг). Растворяется в диметилформамиде в присутствии молекулярного йода, причем концентрация йодида меди в растворе прямо зависит от концентрации молекулярного йода. Плавится без разложения при 605 °C. Не образует кристаллогидратов, но с пиридином образует комплексы состава CuI ⋅ 5Pyr.
Йодид меди (I), как и большинство бинарных соединений с галогенами, является неорганическим полимером. Йодид меди (I) имеет богатую фазовую диаграмму, а это значит, что он существует в нескольких кристаллических формах. Йодид меди (I) принимает структуру сфалерита ниже 390 °C (γ-CuI), структуру вюрцита между 390 и 440 °C (β-CuI) и структуру галита выше 440 °C (α-CuI). Когда Йодид меди (I) принимает структуру сфалерита и вюрцита, ионы располагаются тетраэдрически, на расстоянии 2,338 Å. Бромид меди (I) и хлорид меди (I) аналогично переходят из структуры сфалерита в структуру вюрцита при 405 и 435 °C, соответственно. Межатомные расстояния в бромиде меди (I) и хлориде меди (I) равны 2,173 и 2,051 Å соответственно.
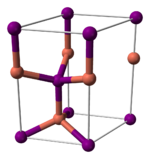 |
||
| γ-CuI | β-CuI | α-CuI |
Химические свойства
Йодид меди (I) не реагирует с гидратом аммиака; подвергается следующим химическим превращениям:
- Йодид меди медленно окисляется кислородом воздуха до йода, что объясняет его окраску.
- 2CuI + O2 ⟶ 2CuO + I2
- переводится в раствор с помощью реакций ионного обмена с концентрированными растворами йодоводородной кислоты, йодида калия, цианида калия, тиосульфата натрия
- окисляется до соединений меди (II) и йода концентрированной азотной кислотой, горячей концентрированной серной кислотой
- 2CuI + 8HNO3 ⟶ I2↓ + 2Cu(NO3)2 + 4NO2↑ + 4H2O
- 4CuI + 5H2SO4 ⟶ 4CuSO4 + 2I2↓ + H2S↑ + 4H2O
- в горячей концентрированной щёлочи разлагается до оксида меди (I)
- 2CuI + 2OH− ⟶ Cu2O↓ + 2I− + H2O
- под действием сильных восстановителей (например, тетрагидроалюмината лития) образует гидрид меди (I)
- 4CuI + Li[AlH4] ⟶ LiI + AlI3 + 4CuH
Получение
Йодид меди (I) может быть получен следующими способами:
- взаимодействием оксида меди (I) с разбавленной йодоводородной кислотой
- Cu2O + 2HI ⟶ 2CuI↓ + H2O
- нагреванием оксида меди (II) с йодидом алюминия
- 6CuO + 4AlI3 →230∘C 6CuI + 2Al2O3 + 3I2
- взаимодействием растворимых солей меди (II) с растворимыми йодидами; образующийся в данной реакции гипотетический Йодид меди (II) мгновенно превращается в Йодид меди (I)
- 2Cu2+ + 4I− ⟶ 2[CuI2] ⟶ 2CuI↓ + I2
- взаимодействием металлической меди (например, в виде порошка) с растворами йода в пиридине или диметилформамиде
- 2Cu + I2 ⟶ 2CuI
Применение
Индикатор паров ртути.
Токсичность
Вызывает раздражение слизистых оболочек (глаз, органов дыхания). Может вызывать раздражение кожи. При проглатывании вызывает раздражение ЖКТ и общее отравление.
Очень опасно для водных организмов. Может вызывать долговременные негативные изменения в водной среде. LC50 для Danio rerio составляет 0,4 мг/л в течение 96 ч.

