Йодид алюминия
Йодид алюминия
| Йодид алюминия | |
|---|---|
 |
|
| Систематическое название | Йодид алюминия |
| Химическая формула | AlI3 |
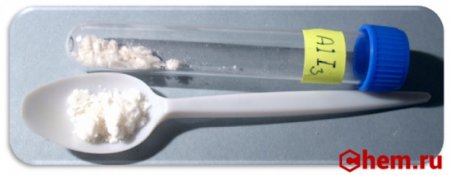
| Внешний вид | кристаллическое вещество белого цвета с желтоватым оттенком |
| Молярная масса | 407,69 г/моль |
| Температура плавления | 188.3 °C (461,45 К) |
| Температура кипения | 382.5 °C (655,65 К) |
| Плотность | 3,98 г/см³ |
| Константа диссоциации pKa | 1) 5,02 2) 5,33 3) 5,87 4) 7,50 |
| Давление пара | 1 мм рт. ст. (178 °C) 10 мм рт. ст. (225 °C) 100 мм рт. ст. (296 °C) |
| Кристаллическая решётка | гексагональная |
| Стандартная энтальпия образования | −308 кДж/моль |
| Энтальпия плавления | +15,9 кДж/моль |
| Стандартная молярная энтропия | +190 Дж/(моль·К) |
| Стандартная энергия образования Гиббса | −304 кДж/моль |
| Регистрационный номер CAS | 7784-23-8 |
| Регистрационный номер EC | 232-054-8 |
| R-фразы | R14; R34; R40; R42/43 |
| S-фразы | S22; S26; S36/37/39; S45 |
| H-фразы | H314; H317 |
| P-фразы | P280; P305 + P351 + P338; P310 |
| Пиктограммы опасности |    |
| Пиктограммы опасности СГС |   |
| Где это не указано, данные приведены при стандартных условиях (25 °C, 100 кПа). | |
Йодид алюминия (Алюминий йодистый) — неорганическое вещество с химической формулой AlI3 . Относится к классу бинарных соединений, также может рассматриваться как соль алюминия и йодоводородной кислоты. Твердое вещество белого цвета с желтоватым оттенком.
Содержание
Физические свойства
Безводный Йодид алюминия при нормальных условиях — белое кристаллическое вещество с гексагональной сингонией кристаллической решётки. Плавится и кипит без разложения, гигроскопичен. Образует кристаллогидрат состава AlI3 ⋅ 6 H2O светло-жёлтого цвета. Кристаллогидрат хорошо растворим в воде, растворим в этаноле, эфире, сероуглероде.
Химические свойства
Йодид алюминия обладает следующими химическими свойствами.
- Реагирует с концентрированной серной кислотой:
- 8 AlI3 + 15 H2SO4 ⟶ 4 Al2(SO4)3 + 12 I2 ↓ + 3 H2S ↑ + 12 H2O
- При поглощении влаги воздуха частично разлагается с образованием осно́вной соли, та же соль образуется при нагревании кристаллогидрата:
- При нагревании раствора йодида алюминия выпадает осадок гидроксида алюминия:
- AlI3 + 3 H2O ⟶ Al(OH)3 ↓ + 3 HI ↑
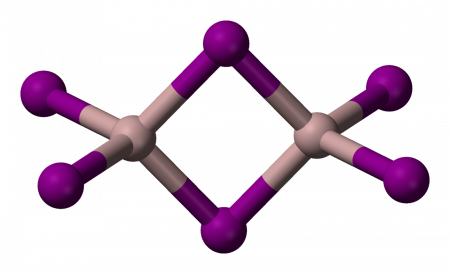
- В газовой фазе при температуре выше 250 °C происходит частичная димеризация:
- 2 AlI3 ⇄ Al2I6
- Кроме того, Йодид алюминия обладает всеми свойствами, общими для растворимых солей алюминия:
-
- при растворении в воде происходит диссоциация, сопровождающаяся гидратацией и последующим многоступенчатым гидролизом катиона; при этом создаётся кислотная среда, в частности, для первой ступени гидролиза константа кислотности равна
- Ka1 = [Al(H2O)5(OH)2+] ⋅ [H3O+ ][Al(H2O)63+] = 9,55 ⋅ 10−6
-
- с разбавленными щелочами образует осадок гидроксида алюминия, с концентрированными разлагается с образованием тетрагидроксоалюмината
- AlI3 + 3 OH− ⟶ Al(OH)3 ↓ + 3I−
- AlI3 + 4 OH− ⟶ [Al(OH)4]− + 3I−
Получение
Йодид алюминия может быть получен непосредственно реакцией порошкообразного алюминия и йода (для реакции необходимо небольшое количество воды в качестве катализатора — образующиеся при реакции йода с водой кислоты растворяют покрывающую алюминий оксидную плёнку, ускоряя реакцию):
- 2 Al + 3 I2 → H2O2AlI3
Применение
Токсичность
Йодид алюминия токсичен, способен вызывать ожоги кожи и слизистых оболочек (глаз, органов дыхания, ЖКТ). Может вызывать аллергические реакции.