Оксид фосфора (V)
Оксид фосфора (V)
| Оксид фосфора | |
|---|---|
 |
|
 |
|
| Систематическое наименование |
Оксид фосфора (V) |
| Хим. формула | P2O5 |
| Состояние | белый порошок |
| Молярная масса | 141,94 г/моль |
| Плотность | 2.39 г/см³ |
| Т. плав. | 420оС(Н-форма),569 (О-форма) |
| Т. кип. | возгоняется при 359 (Н-форма) °C |
| Энтальпия образования | -3010,1 кДж/моль |
| Растворимость в воде | реагирует |
| Рег. номер CAS | [1314-56-3] (P2O5) [16752-60-6] (P4O10) |
| PubChem | 14812 |
| SMILES |
O=P12OP3(=O)OP(=O)(O1)OP(=O)(O2)O3
|
| InChI |
1S/O10P4/c1-11-5-12(2)8-13(3,6-11)10-14(4,7-11)9-12
DLYUQMMRRRQYAE-UHFFFAOYSA-N
|
| RTECS | TH3945000 |
| ChEBI | 37376 |
| ChemSpider | 14128 и 21428497 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Пентаоксид фосфора, также Оксид фосфора (V) (фосфорный ангидрид, пятиокись фосфора) — неорганическое химическое соединение класса кислотных оксидов с формулами P4O10 и P2O5
Содержание
- 1 Строение
- 2 Свойства
- 3 Получение
- 4 Применение
Строение
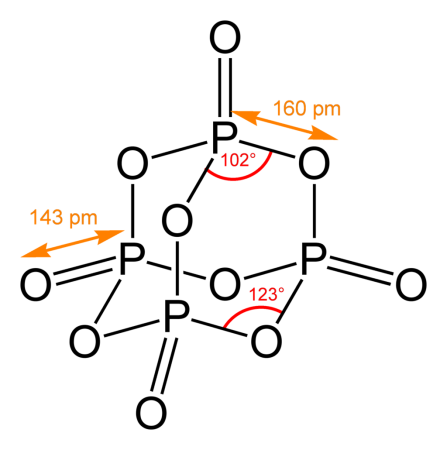
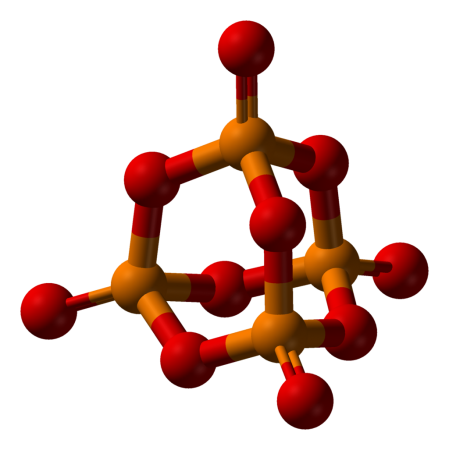
Пары оксида фосфора(V) имеют состав P4O10. Твердый оксид склонен к полиморфизму. Существует в аморфном стекловидном состоянии и кристаллическом. Для кристаллического состояния известны две метастабильные модификации пентаоксида фосфора — гексагональная Н-форма (а = 0,744 нм, = 87°, пространств, гр. R3С) и орторомбическая О-форма (а = 0,923 нм, b = 0,718 нм, с = 0,494 нм, пространств, гр. Рпат), а также одна стабильная орторомбическая О-форма (а =1,63 нм, b= 0,814 нм, с =0,526 нм, пространств. гр. Fdd2). Молекулы P4O10 (Н-форма) построены из 4 групп PO4 в виде тетраэдра, вершины которого занимают атомы фосфора, 6 атомов кислорода располагаются вдоль ребер, а 4 — по оси третьего порядка тетраэдра. Эта модификация легко возгоняется (360°С) и активно взаимодействует с водой. Другие модификации имеют слоистую полимерную структуру из тетраэдров PO4, объединенные в 10-членные (О-форма) и 6-членные (О'-форма) кольца. Эти модификации имеют более высокую температуру возгонки (~580°С) и менее химически активны. H-форма переходит в О-форму при 300—360оC.
Свойства
P4O10 очень активно взаимодействует с водой (H-форма поглощает воду даже со взрывом), образуя смеси фосфорных кислот, состав которых зависит от количества воды и других условий:
-
- P4O10 + 6H2O → 4H3PO4
При сильном нагревании распадается на:
-
- P4O10 → P4O6 + 2O2
Он также способен извлекать воду из других соединений, представляя собой сильное дегидратирующее средство:
-
- 4HNO3 + P4O10 → 4HPO3 + 2N2O5
-
- 4HClO4 + P4O10 → (HPO3)4 + 2Cl2O7
Оксид фосфора(V) широко применяется в органическом синтезе. Он реагирует с амидами, превращая их в нитрилы:
-
- P4O10 + RCONH2 → P4O9(OH)2 + RCN
Карбоновые кислоты переводит в соответствующие ангидриды:
-
- P4O10 + 12RCOOH → 4H3PO4 + 6(RCO)2O
Оксид фосфора(V) также взаимодействует со спиртами, эфирами, фенолами и другими органическими соединениями. При этом происходит разрыв связей P—О—P и образуются фосфорорганические соединения. Реагирует с NH3 и с галогеноводородами, образуя фосфаты аммония и оксигалогениды фосфора:
-
- P4O10 + 8PCl3 + O2 → 12POCl3
При сплавлении P4O10 с основными оксидами образует различные твёрдые фосфаты, природа которых зависит от условий реакции.
Получение
Оксид фосфора(V) получают сжиганием фосфора в избытке кислорода или воздуха. Технологический процесс происходит в камере сжигания и включает в себя окисление элементарного P предварительно осушенным воздухом, осаждение P4O10 и очистку отходящих газов. Очищают полученный пентаоксид возгонкой.
-
- 4P + 5O2 → P4O10
Технический продукт имеет вид белой снегообразной массы, состоящей из смеси разных форм P4O10.
Применение
P4O10 применяют как осушитель газов и жидкостей. Также он является промежуточным продуктом в производстве ортофосфорной кислоты H3PO4 термическим способом.
Широко используется в органическом синтезе в реакциях дегидратации и конденсации.

