Фосфористая кислота
Фосфористая кислота
| Фосфористая кислота | |
|---|---|
 |
|
 |
|
| Систематическое наименование |
фосфоновая кислота |
| Традиционные названия | Фосфористая кислота |
| Хим. формула | H2(PHO3) |
| Состояние | твердое |
| Молярная масса | 82.00 г/моль |
| Плотность | 1.65 г/см³ |
| Т. плав. | 70,1 °C |
| Т. кип. | 200 °C |
| Т. разл. | са 100 °C |
| pKa | 2.0, 6.7 |
| Растворимость в воде | са 80 (20оС) |
| Рег. номер CAS | [13598-36-2] |
| PubChem | 407 |
| Рег. номер EINECS | 237-066-7 |
| SMILES |
OP(O)=O
|
| InChI |
1S/H3O3P/c1-4(2)3/h4H,(H2,1,2,3)
ABLZXFCXXLZCGV-UHFFFAOYSA-N
|
| RTECS | SZ6400000 |
| ChEBI | 44976 |
| Номер ООН | 2834 |
| ChemSpider | 10449259 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
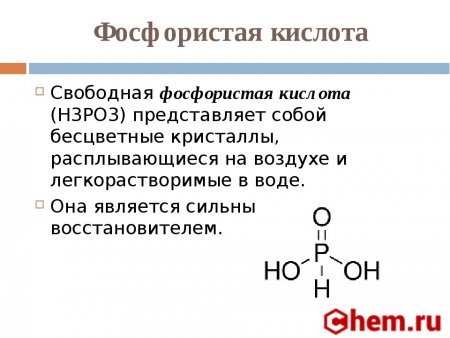
Фосфористая кислота (фосфоновая, H3PO3, H2(HPO3)) — двухосновная в водных растворах, а формально трёхосновная кислота средней силы.
Содержание
Свойства
Безводная Фосфористая кислота — бесцветные гидроскопичные кристаллы. Фосфористая кислота является кислотой средней силы и диссоциирует по двум ступеням:
-
- H 2 ( H P O 3 ) → H + + H ( H P O 3 ) −
-
- H ( H P O 3 ) − → H + + H P O 3 2 −
Константы диссоциации фосфористой кислоты при 18 °C: K1 = 5,1⋅10−2 K2 = 1,8⋅10−7.
При нагревании до 250 °C безводная Фосфористая кислота разлагается на фосфорную кислоту и фосфин, а водные её растворы — на фосфорную кислоту и водород.
-
- 4 H 2 ( H P O 3 ) → 3 H 3 P O 4 + P H 3
Фосфористая кислота легко окисляется галогенами, оксидами азота и пр. до фосфорной кислоты, кислородом окисляется до фосфорноватой кислоты:
-
- 4 H 2 ( H P O 3 ) + O 2 → 2 H 4 P 2 O 6 + 2 H 2 O
Соли фосфористой кислоты называются фосфитами или (по рекомендации ИЮПАК) фосфонатами. Большинство фосфитов малорастворимы в воде. Известны одно- и двузамещённые фосфиты.
Фосфористая кислота и её соли являются сильными восстановителями. Однако активные металлы в кислом растворе восстанавливают H3РО3 до РH3.
Эфиры фосфористой кислоты
При взаимодействии спиртов с чистым PCl3 получаются моно-, ди- и триэфиры фосфористой кислоты с общей формулой P(OR)3, легко образующие комплексы с переходными металлами и другими акцепторами. Они также легко окисляются до соответствующих фосфатов:
-
- 2 ( R O ) 3 P + O 2 → 2 ( R O ) 3 P O
При взаимодействии эфиров с алкилгалогенидами образуются алкилфосфонаты:
-
- 2 ( R O ) 3 P + R ′ X → R ′ ( R O ) 2 P = O + R X
Получение
Получают фосфористую кислоту растворением P4O6 (P2O3) в холодной воде, гидролизом PCl3 или взаимодействием фосфитов с серной или соляной кислотами:
-
- P 2 O 3 + 3 H 2 O → 2 H 2 ( P H O 3 )
-
- P C l 3 + 3 H 2 O → H 2 ( P H O 3 ) + 3 H C l
-
- K 2 H P O 3 + 2 H C l → 2 K C l + H 2 ( P H O 3 )