Оксид свинца IV
Оксид свинца IV
| Оксид свинца IV | |
|---|---|
| Систематическое наименование |
Оксид свинца IV |
| Традиционные названия | Диоксид свинца, Двуокись свинца, платтнерит |
| Хим. формула | PbO2 |
| Рац. формула | PbO2 |
| Состояние | твёрдое |
| Молярная масса | 239,1988 г/моль |
| Плотность | 9,38 г/см³ |
| Температура | |
| • плавления | 290 °C |
| Рег. номер CAS | 1309-60-0 |
| PubChem | 14793 |
| Рег. номер EINECS | 215-174-5 |
| SMILES |
O=[Pb]=O
|
| InChI |
1S/2O.Pb
YADSGOSSYOOKMP-UHFFFAOYSA-N
|
| RTECS | OGO700000 |
| ChemSpider | 14109 |
| Предельная концентрация | 0,01 мг/м³ (в пересчёте на Pb) |
| Токсичность | Высокотоксичен, канцерогенен, мутагенен, сильный окислитель |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
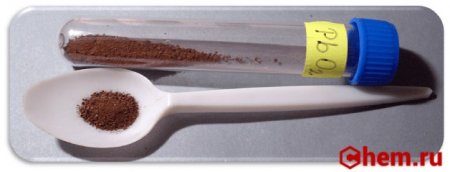
Оксид свинца IV (диоксид свинца, Двуокись свинца) — бинарное неорганическое соединение свинца с кислородом, химическая формула - PbO2. Является высшим оксидом свинца. Представляет собой тёмно-коричневый тяжёлый порошок, имеющий тонкий характерный запах озона. В высоких концентрациях ядовит.
Встречающееся в старой литературе название «перекись свинца», «пероксид свинца» фундаментально неверно, поскольку в структуре соединения отсутствуют пероксидные группы [-O-O-].
Содержание
Химические свойства
Диоксид свинца существует в двух формах — α-PbO2 (коричневый порошок, тетрагональная сингония) и β-PbO2 (чёрный порошок, ромбическая сингония).
Диоксид свинца обладает сильными окислительными свойствами. Окисляет хлорид-анион до хлора из концентрированной соляной кислоты при нагревании:
PbO2 + 4 HCl → PbCl2 + Cl2 ↑ + 2 H2O
Также окисляет соли марганца II в кислой среде до перманганата:
5 PbO2 + 2 MnSO4 + 3 H2SO4 → 5 PbSO4 + 2 HMnO4 + 2 H2O
Сера и фосфор при растирании с диоксидом свинца воспламеняются.
Как и многие другие соединения свинца, его диоксид в больших количествах очень токсичен.
Получение
Промышленный способ производства диоксида свинца заключается в обработке свинцового сурикa азотной кислотой и последующей промывке и сушке в вакууме.
Pb3O4 + 4 HNO3 → PbO2 + 2 Pb(NO3)2 + 2 H2O
Применение
Диоксид свинца находит применение в качестве важного сиккатива, катализатора и окислителя в некоторых химических процессах. Также широко применяется в свинцово-сернокислотных аккумуляторах и гальванических элементах в качестве положительной электродной массы. Небольшое количество диоксида свинца используется в качестве покрытия электродов для электролизных процессов.
Физиологическое действие и токсичность

- Будучи сильнейшим окислителем, диоксид свинца PbO2 является очень ядовитым при попадании в организм в больших концентрациях. По токсикологии NFPA 704 оксиду свинца IV присвоена высшая токсичность. Симптомы отравления: боль в животе, спазмы, тошнота, рвота, головная боль. Острые отравления могут привести к мышечной слабости, металлическому привкусу во рту, потере аппетита, бессоннице, головокружению, шоку, коме и смерти в крайних случаях. Отравление также приводит к повышению уровня свинца в крови и моче. Контакт с кожей или глазами вызывает местное раздражение и боль.
- Предельно допустимая концентрация диоксида свинца в воздухе рабочей зоны составляет 0,01 мг/м³ (в пересчёте на свинец). Класс опасности - I (чрезвычайно опасное химическое вещество).
- Оксид свинца IV PbO2 очень опасен для окружающей среды.
Нахождение в природе
Диоксид свинца встречается в природе в виде минерала платтнерита.