Щавелевая кислота
Щавелевая кислота
| Щавелевая кислота | |
|---|---|
 |
|
 |
|
| Систематическое наименование |
Этандиовая кислота |
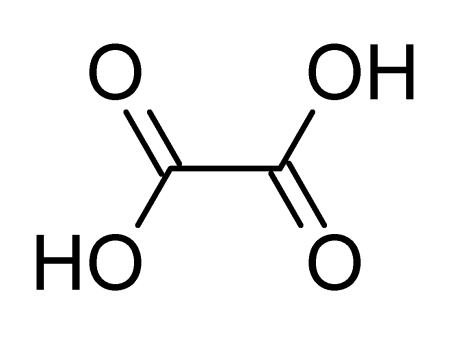
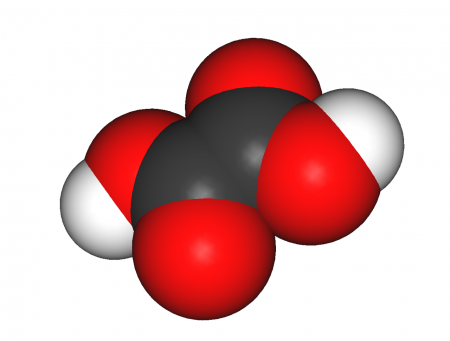
| Хим. формула | HOOC-COOH |
| Состояние | Кристаллическое |
| Молярная масса | 90,04 г/моль |
| Плотность | 1,36 г/см³ |
| Т. плав. |
189,5 °C
|
| Т. субл. |
125 °C
|
| Т. кип. | 100,7 градус Цельсия |
| Т. разл. |
100-130 °C
|
| Т. всп. | 166 °C |
| Мол. теплоёмк. | 108,8 Дж/(моль·К) |
| Энтальпия образования | −817,38 кДж/моль |
| Энтальпия сгорания | −251,8 кДж/моль |
| Энтальпия растворения | −9,58 кДж/моль |
| Энтальпия сублимации | 90,58 кДж/моль |
| Давление пара | 0,001 ± 0,001 мм рт.ст. |
| pKa | 1,25; 4,14 |
| Растворимость в воде | 10 г/100г (20 °C); 25 г/100г (44,5 °C); 120 г/100г (100 °C) |
| Кристаллическая структура | Моноклинная |
| Дипольный момент | 0,1⋅10−30 Кл·м |
| ГОСТ | ГОСТ 22180-76 |
| Рег. номер CAS | 144-62-7 |
| PubChem | 971 |
| Рег. номер EINECS | 205-634-3 |
| SMILES |
C(=O)(C(=O)O)O
|
| InChI |
1S/C2H2O4/c3-1(4)2(5)6/h(H,3,4)(H,5,6)
MUBZPKHOEPUJKR-UHFFFAOYSA-N
|
| RTECS | RO2450000 |
| ChEBI | 16995 и 44583 |
| Номер ООН | 3261 |
| ChemSpider | 946 |
| ПДК | 0,2 мг/л (в воде водоёмов хозяйств бытового пользования) |
| Токсичность | токсична |
| Сигнальное слово | Опасно |
| Пиктограммы СГС | Пиктограммы СГС: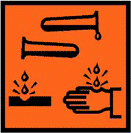  |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Щавелевая кислота, также этандиовая кислота — органическое соединение, двухосновная предельная карбоновая кислота, с формулой HOOC-COOH, простейшая двухосновная кислота, первый член гомологического ряда двухосновных предельных карбоновых кислот. Принадлежит к сильным органическим кислотам. Обладает всеми химическими свойствами, характерными для карбоновых кислот. Соли и сложные эфиры щавелевой кислоты называются оксалатами. В природе содержится в щавеле, ревене, карамболе и некоторых других растениях в свободном виде и в виде оксалатов калия и кальция. Впервые Щавелевая кислота синтезирована в 1824 году немецким химиком Фридрихом Вёлером из дициана.
Получение
В промышленности щавелевую кислоту получают окислением углеводов, спиртов и гликолей смесью HNO3 и H2SO4 в присутствии V2O5, либо окислением этилена и ацетилена HNO3 в присутствии PdCl2 или Pd(NO3)2, а также окислением пропилена жидким NO2. Перспективен способ получения щавелевой кислоты из CO через формиат натрия:
-
- NaOH + CO → HCOONa →−H2 NaOOC-COONa →H+ HOOC-COOH
Свойства
- Энтальпия сгорания (ΔH0сгор) −251,8 кДж/моль
- Температура декарбоксилирования 166—180 °C
Применение
В лабораториях щавелевую кислоту иногда применяют для получения хлороводорода и йодоводорода:
-
- H2C2O4 + Cl2 → 2HCl↑ + 2CO2↑
Также Щавелевая кислота используется для лабораторного синтеза диоксида хлора:
-
- 2KClO3 + H2C2O4 → K2CO3 + 2ClO2↑ + CO2↑ + H2O
Щавелевая кислота и оксалаты находят применение в текстильной и кожевенной промышленности как протрава. Они служат компонентами анодных ванн для осаждения металлических покрытий — алюминия, титана и олова. Щавелевая кислота и оксалаты являются реагентами, используемыми в аналитической и органической химии. Они входят в составы для удаления ржавчины и оксидных плёнок на металле; применяются для осаждения редкоземельных элементов.
Производные щавелевой кислоты — диалкилоксалаты, главным образом диэтилоксалат и дибутилоксалат — применяются как растворители целлюлозы. Ряд сложных эфиров щавелевой кислоты и замещённых фенолов используются как хемилюминесцентные реагенты.
Щавелевая кислота является хорошим стимулятором работы мышц и нервов.

Опасность
Щавелевая кислота и её соли токсичны. Некоторые соли щавелевой кислоты, — оксалаты, в частности, Оксалат кальция и Оксалат магния очень плохо растворимы в воде и оседают в почечных лоханках в виде конкрементов различного размера (песок, камни), иногда причудливой формы (коралловые камни).
ПДК в воде водоёмов хозяйств бытового пользования — 0,2 мг/л.