Оксид золота III
Оксид золота III
| Оксид золота III | |
|---|---|
 |
|
| Систематическое наименование |
Оксид золота III |
| Традиционные названия | Окись золота |
| Хим. формула | Au2O3 |
| Состояние | красно-бурый порошок |
| Молярная масса | 441,93 г/моль |
| Плотность | 10,38 г/см³ |
| Растворимость | |
| • в воде | не раств. |
| Рег. номер CAS | 1303-58-8 |
| PubChem | 164805 |
| Рег. номер EINECS | 215-122-1 |
| SMILES |
[O-2].[O-2].[O-2].[Au+3].[Au+3]
|
| InChI |
1S/2Au.3O/q2*+3;3*-2
DDYSHSNGZNCTKB-UHFFFAOYSA-N
|
| Номер ООН | <-- номер UN --> |
| ChemSpider | 144478 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Оксид золота III — бинарное неорганическое химическое соединение золота и кислорода с формулой Au2O3. Наиболее устойчивый оксид золота.
Получение
Получается из гидроксида золота III Au2O3 x H2O обезвоживанием при нагревании. Полная потеря воды наступает при температуре около 200оC. Полученный таким образом оксид золота(III) аморфен. Имеет красный или красно-бурый цвет. Примесь бурого, как и в случае гидроксида золота III, обычно связывают с присутствием небольшого количества золота(0). Монокристаллы Au2O3 были получены из аморфного оксида гидротермальным синтезом в кварцевой ампуле, заполненной на треть смесью хлорной кислоты HClO4 и перхлората щелочного металла (температура синтеза 235—275оС, давление до 30 МПа). Полученные монокристаллы имели рубиново-красный цвет.
Свойства
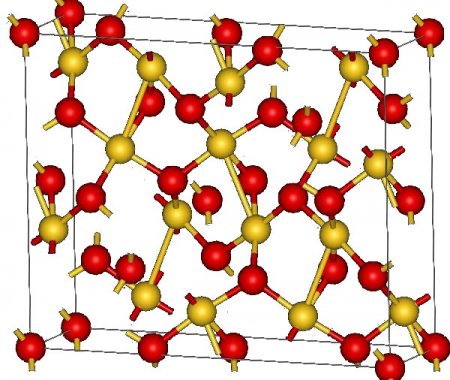
Структура кристаллического Au2O3 орторомбическая, группа Fdd2. Атомы золота имеют тетрагональную (близкую к квадратной) координацию атомами кислорода со средним расстоянием Au-O 2,02—2,03 А. Часть атомов кислорода являются мостиковыми — одни связаны с двумя атомами золота, другие с тремя.
По данным кристаллографии, плотность равна 10,38 г / см3.
Нагрев аморфного оксида золота III до 260—300оС приводит к полному разложению с выделением кислорода и металлического золота, хотя разложение начинается уже при более низкой температуре.
Оксид золота III нерастворим в воде. Заметно, хотя и медленно, растворяется в растворах щелочей, образуя тетрагидроксокомплекс Au(OH)4-. Встречающиеся указания на амфотерность требуют уточнения. Поскольку золото III никогда не образует в растворе простых солей с катионом Au3+, а получаются только комплексные формы, то растворимость Au2O3 в некоторых кислотах обусловлена не только взаимодействием с H+, но в первую очередь именно комплексообразованием с анионом кислоты. Так, Оксид золота III хорошо растворяется в соляной кислоте, давая HAuCl4. Умеренно растворим в азотной и серной кислотах, давая смешанные аквагидроксонитратные или аквагидроксосульфатные комплексы типа Au(OH)i(H2O)jXkz (где i + j + k = 4, X = NO3 или SO4, z = -i + kzX). Нерастворим в хлорной кислоте любой концентрации.
Оксид золота в виде плёнки на инертной подложке испытывался для получения токопроводящих соединений («золотых дорожек») в микроэлектронике. Плёнки получали магнетронным напылением, разложение оксида до золота в нужных местах проводили при помощи лазера