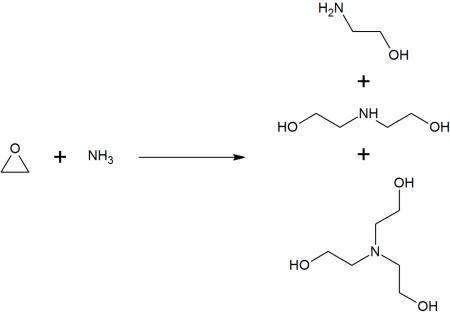Моноэтаноламин
Моноэтаноламин
| Моноэтаноламин | |
|---|---|
 |
|
 |
|
| Систематическое наименование |
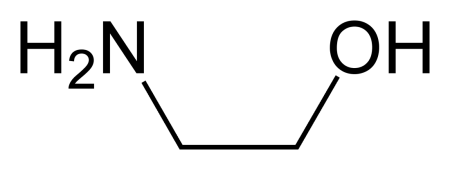
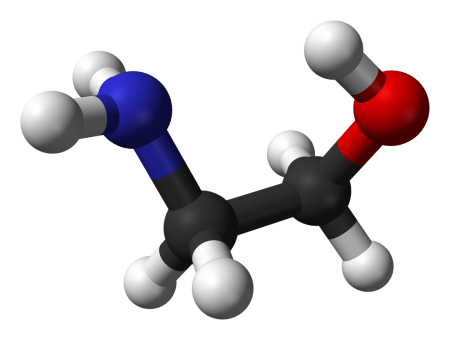
2-Аминоэтан-1-ол 2-Аминоэтанол |
| Сокращения | МЭА |
| Традиционные названия | 2-Амино-l-Этанол, Этаноламин, Моноэтаноламин, β-Аминоэтанол, коламин, глицинол |
| Хим. формула | C2H7NO |
| Молярная масса | 61,08 г/моль |
| Плотность | 1,012 г/см³ |
| Динамическая вязкость | 0,019 Па·с |
| Энергия ионизации | 8,96 ± 0,01 эВ |
| Т. плав. | 10,3 °C |
| Т. кип. | 170 °C |
| Т. всп. | 85 °C |
| Т. свспл. | 450 °C |
| Пр. взрв. | 3 ± 1 об.% |
| Давление пара | 0,4 ± 0,1 мм рт.ст. |
| pKa | 9,50 |
| Растворимость в воде | смешивается |
| Растворимость в гептане | 0,41 г/100 мл |
| Показатель преломления | 1,4539 (20°C) |
| ГОСТ | ТУ 2423-159-00203335-2004 ГОСТ 19234-87 |
| Рег. номер CAS | 141-43-5 |
| PubChem | 700 |
| Рег. номер EINECS | 205-483-3 |
| SMILES |
NCCO
|
| InChI |
1S/C2H7NO/c3-1-2-4/h4H,1-3H2
HZAXFHJVJLSVMW-UHFFFAOYSA-N
|
| RTECS | KJ5775000 |
| ChEBI | 16000 |
| ChemSpider | 13835336 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Моноэталомин - (Этаноламин) HO-CH2CH2-NH2 (2-аминоэтанол, тривиальное название коламин) — простейший стабильный аминоспирт, является первичным амином и первичным спиртом. Также называется моноэтаноламином для отличия от диэтаноламина (NH(CH2CH2OH)2) и триэтаноламина (N(CH2CH2OH)3).
Содержание
- 1 Физические свойства
- 2 Получение
- 3 Химические свойства
- 4 Биологическая роль
- 5 Применение
- 6 Безопасность

Физические свойства
Вязкая маслянистая жидкость с температурой кипения 170 °C. Имеет слабый аминный запах. Смешивается с водой во всех отношениях. Хорошо растворим в этаноле, бензоле, хлороформе.
Получение
В промышленности синтез этаноламина проводится присоединением аммиака к этиленоксиду в присутствии небольшого количества воды. Процесс осуществляют в одну стадию при температуре 90—130 °С и давлении 7—10 МПа.
Наряду с моноэтаноламином при этом получаются Диэтаноламин и Триэтаноламин. При соотношении этиленоксид/аммиак (1:15) в продуктах реакции содержится 78,3 % моно-, 16 % ди- и 4,4 % триэтаноламинов. Этиленоксид в реакции реагирует нацело.
Соотношение этаноламинов в смеси регулируют концентрацией NH3, температурой процесса и повторным направлением в реакцию одного или двух этаноламинов.
Образующуюся смесь этаноламинов, H2O и NH3 разделяют ректификацией, при этом аммиак в сжиженном виде повторно направляют в реактор.
- (CH2)2O + NH3 → HOCH2CH2NH2
- HOCH2CH2NH2 + (CH2)2O → (HOCH2CH2)2NH + (HOCH2CH2)3N
В лаборатории этаноламин получают действием аммиака на этиленхлоргидрин (2-хлорэтанол):
- HOCH2CH2Cl + NH3 → HOCH2CH2NH2 + HCl
Химические свойства
Этаноламин — слабое основание (pKa=9.50). С минеральными и сильными органическими кислотами образует соли.
При взаимодействии со сложными эфирами и карбоновыми кислотами или их ангидридами и хлорангидридами Моноэтаноламин превращается в соответствующие N-(2-гидрооксиэтил)амиды кислот:
- HOCH2CH2NH2 + RCOCl → HOCH2CH2NHCOR + HCl
Моноэтаноламин с альдегидами (за исключением формальдегида) и кетонами даёт основания Шиффа, последние обычно находятся в равновесии с изомерными оксазолидинами:
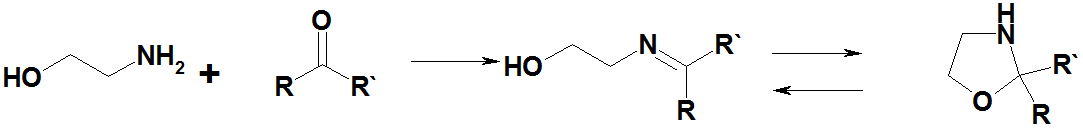
При взаимодействии солей моноэтаноламина с KCN или NaCN и альдегидами и кетонами образуются N-(гидроксиэтил)аминонитрилы:
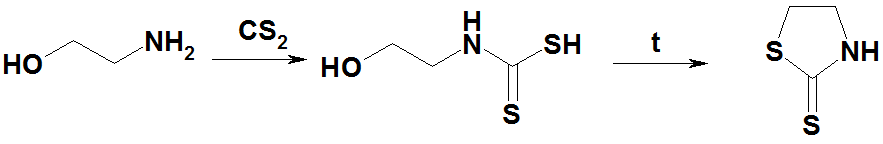
Моноэтаноламин при реакции с CS2 образует N-(2-гидроксиэтил)дитиокарбаминовую кислоту, которая при нагревании даёт меркаптотиазолин:
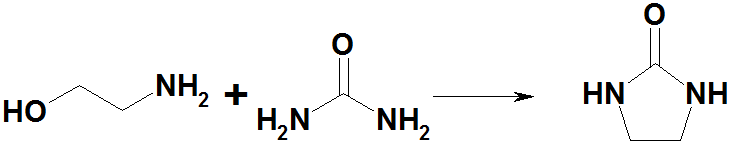
При нагревании с мочевиной образуется этиленмочевина:
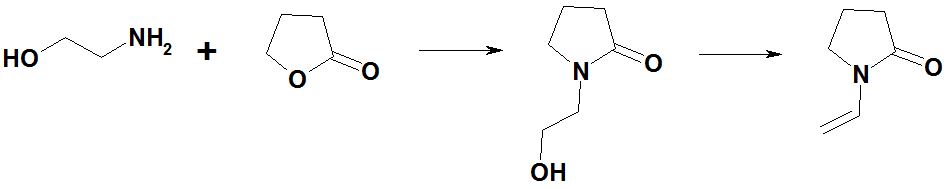
С γ-бутиролактоном — N-(2-гидроксиэтил)пирролидон, который далее превращается в N-винилпирролидон:
Аммонолиз моноэтаноламина в присутствии H2 и катализаторов гидрирования (Ni или Cu) приводит к образованию этилендиамину:
- HOCH2CH2NH2 + NH3 → H2NCH2CH2NH2 + H2O
Биологическая роль
Этаноламин всегда присутствует в незначительном количестве в организме человека и животных при полноценном белковом питании. В организме он образуется при декарбоксилировании аминокислоты серина. Дальнейшие пути превращений связаны либо с синтезом одного из фосфатидов — кефалина, являющегося фосфатидилэтаноламином, либо с превращением этаноламина в холин.
Применение
Водные растворы этаноламина обладают щелочной реакцией и хорошо поглощают кислые газы (диоксид углерода, диоксид серы, сероводород, а также газообразные и летучие тиолы). При нагреве раствора поглощённые газы выделяются, регенерированный раствор повторно направляют для поглощения. Благодаря обратимости растворы этаноламина широко используются в качестве абсорбента в различных процессах газоочистки (например, удаление примесей сероводорода, углекислого газа и тиолов в нефтегазовой и нефтехимической промышленности) и для разделения газов (в частности, абсорбция углекислого газа из смеси газов при производстве водорода конверсией метана).
Применяется в средствах для окраски волос в качестве заменителя раствора аммиака.
Этаноламин также является исходным веществом в промышленном синтезе таурина.
Безопасность
Летальная доза (ЛД50 700 мг/кг (для белых мышей, перорально).
При остром отравлении возникает раздражение слизистых оболочек, урежение дыхания, двигательное возбуждение, судороги. У белых крыс, вдыхавших воздух с концентрацией этаноламина 0,2—0,4 мг/л по 5 часов ежедневно в течение 6 месяцев наблюдались изменения функционального состояния центральной нервной системы и функций печени, незначительная анемия и ретикулоцитоз, повышенный диурез и белок в моче.
Крысы, подвергавшиеся практически непрерывному отравлению в течение 30 суток при концентрации 0,164 мг/л, погибали через 14—24 суток, но выживали в тех же условиях в течение 90 дней при концентрации 0,029 мг/л. Морские свинки при непрерывном вдыхании 0,184 мг/л погибали между 10 и 28 днём. Концентрация 0,037 мг/л переносилась в течение 90 суток, а 0,12 мг/л вызывала лишь слабые признаки отравления. Собаки пережили в течение 30 дней вдыхание 0,25 мг/л и 0,015 мг/л в течение 60 дней.
Санитарная норма по ПДК в воздухе рабочей зоны не более 1 мг/м3.