Малеиновая кислота
малеиновая кислота
| малеиновая кислота | |||
|---|---|---|---|
|
|||
| Систематическое наименование |
цис-бутендиовая кислота | ||
| Традиционные названия | малеиновая кислота | ||
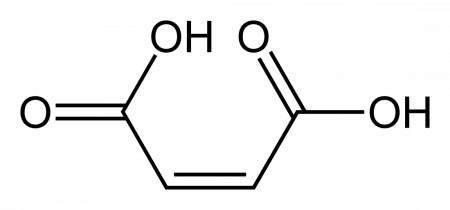
| Хим. формула | HOOC-CH=CH-COOH | ||
| Рац. формула | H4C4O4 | ||
| Состояние | твердое | ||
| Молярная масса | 116,07 г/моль | ||
| Плотность | 1,59 г/см³ | ||
| Температура | |||
| • плавления | 135 °C | ||
| • разложения | 135 °C | ||
| • вспышки | 127 °C | ||
| Константа диссоциации кислоты pKa | pka1 = 1,9 pka2 = 6,07 |
||
| Растворимость | |||
| • в воде | 78,8 г/100 мл | ||
| ГОСТ | ГОСТ 9803-75 | ||
| Рег. номер CAS | 110-16-7 | ||
| PubChem | 444266 | ||
| Рег. номер EINECS | 203-742-5 | ||
| SMILES |
C(=CC(=O)O)C(=O)O
|
||
| InChI |
1S/C4H4O4/c5-3(6)1-2-4(7)8/h1-2H,(H,5,6)(H,7,8)/b2-1-
VZCYOOQTPOCHFL-UPHRSURJSA-N
|
||
| RTECS | OM9625000 | ||
| ChEBI | 18300 | ||
| ChemSpider | 392248 | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
малеиновая кислота — органическое соединение с формулой HOOC-CH=CH-COOH. Двухосновная непредельная кислота.
Название по номенклатуре IUPAC — цис-бутендиовая кислота. Её транс-изомер называется фумаровой кислотой.
Соли и сложные эфиры малеиновой кислоты называются малеаты.
Наиболее часто она используется для получения фумаровой кислоты.
Содержание
Физические свойства
Молекула малеиновой кислоты менее стабильна чем фумаровой кислоты. Разница их теплот сгорания равна 22,7 кДж/моль.
малеиновая кислота хорошо растворима в воде (78,8 г/л при 25 °C), а фумаровая кислота — плохо (6,3 г/л при 25 °C). Эти свойства объясняются образованием внутримолекулярной водородной связи в молекуле малеиновой кислоты.
История и методы синтеза
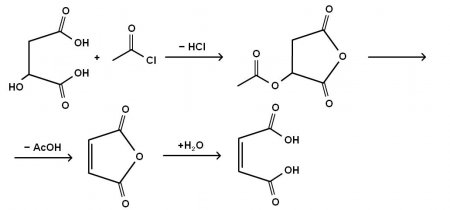
малеиновая кислота впервые была получена Лассэнем в 1819 г. перегонкой яблочной кислоты. По Перкину (1881 г.), для её получения яблочную кислоту обрабатывают ацетилхлоридом, получая ацетил-яблочный ангидрид, который разлагается с образованием уксусной кислоты и малеинового ангидрида, гидратацией которого получают малеиновую кислоту.
Общая схема процесса:
Производство в промышленности
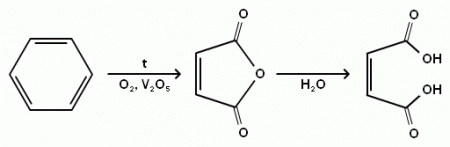
В промышленности малеиновую кислоту получают гидролизом малеинового ангидрида, который получают каталитическим окислением бензола по схеме:
Применение в промышленности
Наиболее важным применением малеиновой кислоты является использование её в производстве фумаровой кислоты. Для производства фумаровой кислоты малеиновою кислоту каталитически (катализаторы — тиомочевина, неорганические кислоты) изомеризуют. Очень малая растворимость фумаровой кислоты сильно упрощает её отделение от непрореагировавшей малеиновой кислоты. Эти кислоты являются геометрическими изомерами, они не могут самопроизвольно превращаться одна в другую. Это объясняется тем, что для их взаимопревращение нужно разорвать π связь между атомами углерода. Путём озонолиза малеиновою кислоту превращают в глиоксиловою кислоту.
Другие реакции
Малеиновою кислоту можно превратить в яблочную кислоту путём гидратации, в янтарную кислоту путём гидрирования, в малеиновый ангидрид путём дегидратации. Вышеперечисленные реакции не используются в промышленности для производства перечисленных веществ, потому что они являются экономически невыгодными.