Янтарная кислота
янтарная кислота
| янтарная кислота | |
|---|---|
 |
|
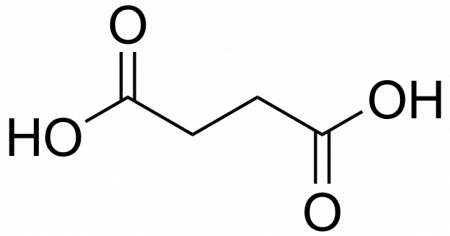
| Хим. формула | C4H6O4 |
| Рац. формула | HOOC-CH2-CH2-COOH |
| Молярная масса | 118.09 г/моль |
| Температура | |
| • плавления | 183 |
| ГОСТ | ГОСТ 6341-75 |
| Рег. номер CAS | 110-15-6 |
| PubChem | 1110 |
| Рег. номер EINECS | 203-740-4 |
| SMILES |
C(CC(=O)O)C(=O)O
|
| InChI |
1S/C4H6O4/c5-3(6)1-2-4(7)8/h1-2H2,(H,5,6)(H,7,8)
KDYFGRWQOYBRFD-UHFFFAOYSA-N
|
| Кодекс Алиментариус | E363 |
| ChEBI | 15741 |
| ChemSpider | 1078 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
янтарная кислота (бутандиовая кислота, этан-1,2-дикарбоновая кислота) — двухосновная предельная карбоновая кислота. Бесцветные кристаллы, растворимые в воде и спирте. Содержится в небольших количествах во многих растениях, янтаре. Стимулирует рост и повышает урожай растений, ускоряет развитие кукурузы. В промышленности янтарную кислоту получают главным образом гидрированием малеинового ангидрида.
Впервые получена в XVII веке перегонкой янтаря. Соли и эфиры янтарной кислоты называются сукцинатами (лат. succinum — янтарь).
Содержание
- 1 Свойства
- 1.1 Органолептические
- 1.2 Физические
- 1.3 Химические
- 2 Биохимическая роль
- 3 Применение
- 3.1 В медицине
Свойства
Органолептические
янтарная кислота представляет из себя белые кристаллы, обладающие слабокислым и слегка солоновато-горьким привкусом.
Физические
Температура плавления 183 градуса. Выше 235 °C отщепляет H2O и переходит в янтарный ангидрид. янтарная кислота легко возгоняется при 130—140 °С. Растворимость в воде (граммов в 100 г воды): 6,8 (при 20 °С), 121 (при 100 °С). Также растворяется в этиловом спирте: 9,9 (5 °С); в диэтиловом эфире — 1,2 (при 15 °С). Нерастворима кислота в бензоле, бензине, хлороформе. Константы диссоциации таковы: Ka1 = 7,4*10−5, Ka2 = 4,5*10−6.
Химические
Метиленовые группы янтарной кислоты обладают высокой реакционной способностью, что связано с влиянием карбоксильных групп. При бромировании янтарная кислота даёт дибромянтарную кислоту HOOC—(CHBr)2—COOH. Диэфиры янтарной кислоты конденсируются с кетонами (конденсация Штоббе) и с альдегидами.
С аммиаком и аминами янтарная кислота образует сукцинимид и его N-замещённые аналоги (R-H, алкильная или арильная группа). Моно- и диамиды янтарной кислоты, получаемые с ароматическими и гетероциклическими аминами, применяют для синтеза некоторых красителей, инсектицидов и лекарственных веществ.
янтарная кислота и её ангидрид легко вступают в реакцию Фриделя-Крафтса с ароматическими соединениями (так называемое сукцинилирование), образуя производные 4-арил-4-кетомасляной кислоты.
Биохимическая роль
янтарная кислота участвует в процессе клеточного дыхания кислорододышащих организмов (см. Цикл трикарбоновых кислот).
Летальные дозы (LD50): орально — 2,26 г/кг (крысы), внутривенно — 1,4 г/кг (мыши). ПДК в воде водоёмов 0,01 мг/л
Применение
янтарная кислота используется в аналитической химии, а также в химическом синтезе для получения пластмасс, смол и лекарственных препаратов.
В пищевой промышленности используется в качестве подкислителя, известна также как пищевая добавка E363.
В медицине
В лекарственных препаратах янтарная кислота применяется в качестве активного вещества как метаболическое средство, улучшающее метаболизм и энергообеспечение тканей, уменьшающее гипоксию тканей.
При воздействии сукцината и гиалуроновой кислоты на клетки кожи достигается омолаживающий эффект редермализации.