Хлорид фосфора V
Хлорид фосфора V
Пентахлорид фосфора (хлорид фосфора V, хлорангидрид фо́сфорной кислоты, пятихлористый фосфор) — высший хлорид фосфора, бинарное неорганическое химическое соединение фосфора и хлора с формулой PCl5.
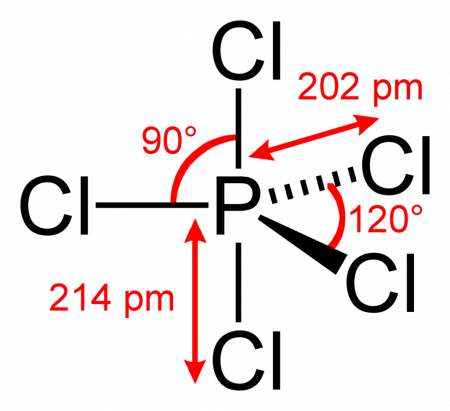
Молекула PCl5 в газообразном или жидком состояниях имеет конфигурацию тригональной бипирамиды с атомом фосфора в основании. Твёрдый пентахлорид фосфора состоит из тетраэдрических ионов [PCl4]+ и октаэдрических ионов [РCl6]− (d P—Cl в тетраэдре 0,197 нм, в октаэдре 0,204 нм (экваториальные) и 0,208 нм (апикальные)).
Свойства
При нагревании выше 300 °C полностью разлагается на PCl3 и Cl2.
Пентахлорид фосфора - типичное кислотное соединение. Он энергично реагирует с водой, образуя по первой стадии оксохлорид фосфора V:
-
- PCl5 + H2O → POCl3 + 2 HCl
В горячей воде гидролиз протекает полностью, до образования ортофосфорной кислоты:
-
- PCl5 + 4 H2O → H3PO4 + 5 HCl
Для PCl5 характерны реакции окислительного хлорирования:
-
- PCl5 + 2 NO2 → PCl3 + 2 NO2Cl
C концентрированной серной кислотой образует хлорсульфоновую кислоту:
-
- PCl5 + H2SO4 → ClSO2OH + POCl3 + HCl
При нагревании PCl5 и NH4Cl происходит реакция образования полимера фосфонитрилхлорида:
-
- nPCl5 + nNH4Cl → (PNCl2)n + 4 nHCl
(PNCl2)n — прозрачное эластичное вещество, «неорганический каучук». Выдерживает нагревание выше 200 °C. Однако фосфонитрилхлорид сравнительно легко гидролизуется, что затрудняет его практическое использование. Заменой атомов хлора на органические радикалы можно получить водоустойчивые полимеры.
Получение
Получают действием избытка хлора на хлорид фосфора III:
-
- PCl3 + Cl2 ⇄ PCl5, ΔH =−124 kJ/mol
Основные сферы применения
PCl5 (пятихлористый фосфор) является сильнейшим хлорирующим агентом, его используют при получении хлорангидридов фосфорных и фосфоновых кислот из олефинов, в производстве лекарственных средств и красителей.
Физиологические свойства
Хлорид фосфора V PCl5 является очень токсичным веществом (сильнейший неорганический яд). Является мощным окислителем. Вызывает ожоги кожи.
ПДК 0,2 мг/м3. Класс опасности - 2.