Неон
Неон
| 10 |
Неон
|
|
Ne
|
|
| 2s22p6 | |
Неон (Ne, лат. neon) — химический элемент 18-й группы (по устаревшей классификации — элемент главной подгруппы VIII группы) второго периода периодической системы с атомным номером 10.
Пятый по распространённости элемент Вселенной после водорода, гелия, кислорода и углерода. Как простое вещество представляет собой инертный одноатомный газ без цвета и запаха. Обнаружен (наряду с ксеноном и аргоном) в 1898 году путём вывода из жидкого воздуха водорода, кислорода, аргона и углекислого газа.
Содержание
- 1 История
- 2 Распространённость
- 2.1 Во Вселенной
- 2.2 Земная кора
- 3 Определение
- 4 Физические свойства
- 5 Химические свойства
- 6 Изотопы
- 7 Получение
- 8 Применение
- 9 Физиологическое действие

История
Неон открыли в июне 1898 года английские химики Уильям Рамзай и Морис Траверс. Они выделили этот инертный газ «методом исключения» после того, как Кислород, азот, аргон и все более тяжёлые компоненты воздуха были сжижены. В декабре 1910 года французский изобретатель Жорж Клод создал газоразрядную лампу, заполненную неоном.
Происхождение названия
Название происходит от греч. νέος — новый.
Существует легенда, согласно которой название элементу дал тринадцатилетний сын Рамзая — Вилли, который спросил у отца, как тот собирается назвать новый газ, заметив при этом, что хотел бы дать ему имя novum (лат. — новый). Его отцу понравилась эта идея, однако он посчитал, что название neon, образованное от греческого синонима, будет звучать лучше.
Распространённость
Во Вселенной
В мировой материи неон распределён неравномерно, однако в целом по распространенности во Вселенной он занимает пятое место среди всех элементов — около 0,13 % по массе. Наибольшая концентрация неона наблюдается на Солнце и других горячих звёздах, в газовых туманностях, в атмосфере внешних планет Солнечной системы — Юпитера, Сатурна, Урана, Нептуна. В атмосфере многих звёзд неон занимает третье место после водорода и гелия.
Земная кора
Из всех стабильных элементов второго периода неон — самый малораспространённый на Земле. В рамках восьмой группы неон по содержанию в земной коре занимает третье место — после аргона и гелия. Газовые туманности и некоторые звезды содержат неона во много раз больше, чем на Земле.
На Земле наибольшая концентрация неона наблюдается в атмосфере — 1,82⋅10−3% по объёму, а его общие запасы оцениваются в 7,8⋅1014 м³. В 1 м³ воздуха содержится около 18,2 см³ неона (для сравнения: в том же объёме воздуха содержится только 5,2 см³ гелия). Среднее содержание неона в земной коре мало − 7⋅10−9% по массе. Всего на нашей планете около 6,6⋅1010 т неона. В изверженных породах находится около 109 т этого элемента. По мере разрушения пород газ улетучивается в атмосферу. В меньшей мере атмосферу снабжают неоном и природные воды.
Причину неоновой бедности нашей планеты ученые усматривают в том, что некогда Земля потеряла свою первичную атмосферу, которая и унесла с собой основную массу инертных газов, которые не могли, как Кислород и другие газы, химически связаться с другими элементами в минералы и тем самым закрепиться на планете.
Определение
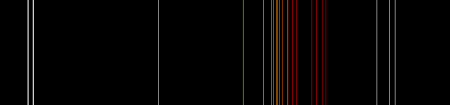
Качественно неон определяют по спектрам испускания (характеристические линии 585,25 нм и 540,05 нм), количественно — масс-спектрометрическими и хроматографическими методами анализа.
Физические свойства
- Благородные газы — бесцветные одноатомные газы без вкуса и запаха.
- Инертные газы обладают более высокой электропроводностью по сравнению с другими газами и при прохождении через них тока ярко светятся, в частности, неон — огненно-красным светом, так как самые яркие его линии лежат в красной части спектра.
- Насыщенность внешних электронных оболочек атомов инертных газов обусловливает более низкие точки сжижения и отвердевания, чем у других газов с близкими молекулярными массами.
Химические свойства
Все благородные газы имеют завершённую электронную оболочку, поэтому они химически инертны. Химическая инертность неона исключительна, в этом с ним может конкурировать только гелий. Пока не получено ни одного его валентного соединения. Даже так называемые клатратные соединения неона с водой (Ne·6H2O), гидрохиноном и другими веществами (подобные соединения тяжелых благородных газов — радона, ксенона, криптона и даже аргона — широко известны) получить и сохранить очень трудно.
Однако, с помощью методов оптической спектроскопии и масс-спектрометрии установлено существование ионов Ne+, (NeAr)+, (NeH)+, и (HeNe)+.
Изотопы
Существует три стабильных изотопа неона: 20Ne (изотопная распространённость 90,48 %), 21Ne (0,27 %) и 22Ne (9,25 %).
Кроме трёх стабильных нуклидов неона, существует ещё шестнадцать нестабильных изотопов. Повсеместно преобладает лёгкий 20Ne.
Во многих альфа-активных минералах относительное содержание тяжелых 21Ne и 22Ne в десятки и сотни раз больше содержания их в воздухе. Это вызвано тем, что основными механизмами образования этих изотопов являются ядерные реакции, происходящие при бомбардировке ядер алюминия, натрия, магния и кремния продуктами распада ядер тяжёлых элементов. Кроме того, подобные реакции происходят в земной коре и атмосфере под воздействием космического излучения.
Зафиксирован также ряд малопродуктивных ядерных реакций, при которых образуются 21Ne и 22Ne — это захват альфа-частиц ядрами тяжёлого кислорода 18O и фтора 19F:
-
- 818O + 24He → 1021Ne + 01n
-
- 919F + 24He → 1022Ne + 11H
Источник преобладающего на Земле лёгкого нуклида 20Ne до сих пор не установлен.
Обычно, Неон-20 образуется в звёздах вследствие альфа-процесса, при котором альфа-частица поглощается ядром атома кислорода
с излучением гамма-кванта:
-
- 816O + 24He → 1020Ne + γ;
Но этот процесс требует температуры более 100 миллионов градусов и массы звезды более трех солнечных.
Вполне возможно, источником изотопа являлась сверхновая, после взрыва которой образовалось газопылевое облако, из части которого сформировалась Солнечная система.
Считается, что в космическом пространстве неон также преимущественно представлен лёгким нуклидом 20Ne. В метеоритах обнаруживают немало 21Ne и 22Ne, но эти нуклиды предположительно образуются в самих метеоритах под воздействием космических лучей за время странствий во Вселенной.
Получение
Неон получают совместно с гелием в качестве побочного продукта в процессе сжижения и разделения воздуха на крупных промышленных установках. Разделение «неоно-гелиевой» смеси осуществляется несколькими способами за счёт адсорбции и конденсации и низкотемпературной ректификации.
Адсорбционный метод основан на способности неона, в отличие от гелия, адсорбироваться активированным углём, охлаждаемым жидким азотом. Конденсационный способ основан на вымораживании неона при охлаждении смеси жидким водородом, ректификационный способ основан на разнице температур кипения гелия и азота.
Неон извлекают из воздуха в аппаратах двукратной ректификации жидкого воздуха. Газообразные неон и гелий скапливаются в верхней части колонны высокого давления, то есть в конденсаторе-испарителе, откуда под давлением около 0.55 МПа подаются в трубное пространство дефлегматора, охлаждаемое жидким N2. Из дефлегматора обогащенная смесь Ne и Не направляется для очистки от N2 в адсорберы с активированным углем, из которых после нагревания поступает в газгольдер (содержание Ne + He до 70 %); степень извлечения смеси газов 0.5-0.6. Последнюю очистку от N2 и разделение Ne и Не можно осуществлять либо селективной адсорбцией при температуре жидкого N2, либо конденсационными методами — с помощью жидких H2 или Ne. При использовании жидкого водорода дополнительно проводят очистку от примеси водорода с помощью CuO при 700 °C. В результате получают неон 99,9%-ной чистоты по объёму.
Основным промышленным способом получения неона (в последнее десятилетие) является разделение неоно-гелиевой смеси путём низкотемпературной ректификации — смесь неона и гелия предварительно очищают от примеси азота и водорода (водород выжигают в печи, заполненной катализатором), а азот в низкотемпературных дефлегматорах и в блоке криогенных адсорберов, заполненных активированным углём (уголь охлаждается змеевиками с кипящим в них под вакуумом азотом). После удаления азота неоно-гелиевая смесь сжимается компрессором и поступает в ректификационную колонну (предварительно охлаждаемая до температуры кипящего под вакуумом азота) для разделения. Для понижения температуры охлаждённая смесь дросселируется с 25 МПа до 0,2-0,3 МПа (в зависимости от режима работы установки). В верхней части колонны, из-под крышки конденсатора, отбирается гелий с примесью до 20 % неона, в нижней части колонны в жидком виде получается неон. В качестве холодильного цикла используется дроссельный холодильный цикл с рабочей средой-хладагентом чистым неоном. Ректификационный метод разделения неоно-гелиевой смеси позволяет получить неон чистотой до 99,9999 %.
Промышленные установки по получению неона высокой чистоты построены и успешно эксплуатируются на Украине — г. Мариуполь (предприятие «Ингаз») и г. Одесса (предприятие «Айсблик»), в Российской Федерации — г. Москва.
Применение
Жидкий неон используют в качестве охладителя в криогенных установках. Ранее неон применялся в промышленности в качестве инертной среды, но был вытеснен более дешёвым аргоном. Неоном наполняют газоразрядные лампы, сигнальные лампы в радиотехнической аппаратуре, фотоэлементы, выпрямители. Смесь неона и гелия используют как рабочую среду в газовых лазерах (гелий-неоновый лазер).
Трубки, заполненные смесью неона и азота, при пропускании через них электрического разряда дают красно-оранжевое свечение, в связи с чем они широко используются в рекламе. По традиции «неоновыми» часто называют также разрядные трубки других цветов, в реальности использующие свечение других благородных газов или флуоресцирующего покрытия (см. справа). Для получения любых цветов, кроме красного, используют электрический разряд в аргоне с добавлением небольших количеств паров ртути в газоразрядных трубках, изнутри покрытых люминофором нужного цвета свечения, преобразующих ультрафиолетовое излучение разряда в видимый свет, или разряд в смеси других благородных газов.
Неоновые лампы применяются для сигнальных целей на маяках и аэродромах, так как их красный цвет очень слабо рассеивается туманом и мглой.
Физиологическое действие
Инертные газы обладают физиологическим действием, которое проявляется в их наркотическом воздействии на организм. Наркотическое воздействие неона (как и гелия) при нормальном давлении в опытах не регистрируется, а при повышении давления первыми возникают симптомы «неврологического синдрома высокого давления» (НСВД).
В связи с этим, наряду с гелием, неон в составе неоно-гелиевой смеси используется для дыхания океанавтов, водолазов, людей, работающих при повышенных давлениях, чтобы избежать газовой эмболии и азотного наркоза. Преимущество смеси в том, что она меньше охлаждает организм, так как теплопроводность неона меньше, чем гелия.
Лёгкий неоно-гелиевый воздух облегчает также состояние больных, страдающих расстройствами дыхания.
Высокая концентрация неона во вдыхаемом воздухе может вызвать головокружение, тошноту, рвоту, потерю сознания и смерть от асфиксии.