Гидразин
гидразин
| гидразин | |
|---|---|
 |
|
 |
|
 |
|
| Систематическое наименование |
гидразин |
| Хим. формула | N2H4 |
| Состояние | бесцветная жидкость |
| Молярная масса | 32,05 г/моль |
| Плотность | 1,01 г/см³ |
| Энергия ионизации | 8,93 ± 0,01 эВ |
| Т. плав. | +2 °C |
| Т. кип. | 114 °C |
| Т. всп. | 99 ± 0 °F |
| Пр. взрв. | 2,9 ± 0,1 об.% |
| Давление пара | 10 ± 1 мм рт.ст. |
| pKa | 8,1 ± 0,01 |
| Растворимость в воде | смешивается |
| Рег. номер CAS | [302-01-2] |
| PubChem | 9321 |
| Рег. номер EINECS | 206-114-9 |
| SMILES |
NN
|
| InChI |
1S/H4N2/c1-2/h1-2H2
OAKJQQAXSVQMHS-UHFFFAOYSA-N
|
| RTECS | MU7175000 |
| ChEBI | 15571 |
| Номер ООН | 2029 |
| ChemSpider | 8960 |
| Пиктограммы СГС | 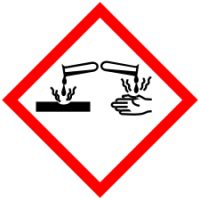    |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
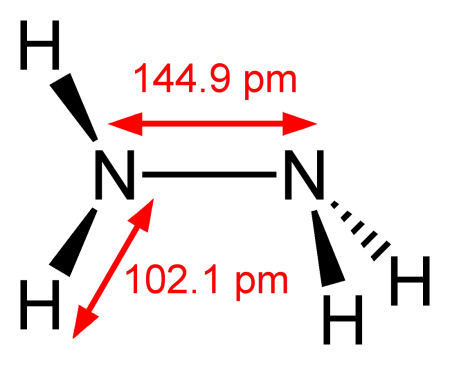
гидразин (диамин) H2N—NH2 — бесцветная, чрезвычайно токсичная, сильно гигроскопическая жидкость, с неприятным запахом.
Молекула N2H4 состоит из двух групп NH2, повёрнутых друг относительно друга, что обусловливает полярность молекулы гидразина, μ = 0,62⋅10−29 Кл · м. Смешивается в любых соотношениях с водой, жидким аммиаком, этанолом; в неполярных растворителях растворяется плохо. Образует органические производные: алкилгидразины и арилгидразины.
Был открыт в 1887 году Теодором Курциусом.
Содержание
Свойства
Термодинамически гидразин значительно менее устойчив, чем аммиак, так как связь N—N не очень прочна: разложение гидразина — экзотермическая реакция, протекающая в отсутствие катализаторов при 200—300 °C:
-
- 3N2H4 → 4NH3 + N2
Переходные металлы (Co, Ni, Cu, Ag) катализируют разложение гидразина. При катализе платиной, родием и палладием основными продуктами разложения являются азот и водород:
-
- N2H4 → N2 + 2H2
Благодаря наличию двух неподелённых пар электронов у атомов азота, гидразин способен к присоединению одного или двух ионов водорода. При присоединении одного протона получаются соединения гидразиния с зарядом 1+, двух протонов — гидразония с зарядом 2+, содержащие соответственно ионы N2H5+ и N2H62+. Водные растворы гидразина обладают основными свойствами, но его основность значительно меньше, чем у аммиака:
-
- N2H4 + H2O → [N2H5]+ + OH− , Kb = 3,0 ⋅ 10−6
(для аммиака Kb = 1,78⋅10−5)
Протонирование второй неподеленной пары электронов протекает ещё труднее:
-
- [N2H5]+ + H2O → [N2H6]2+ + OH− , Kb = 8,4 ⋅ 10−16
Известны соли гидразина — хлорид гидразиния (гидразин солянокислый) N2H5Cl, сульфат гидразиния (гидразин сернокислый N2H6SO4 и т. д. Иногда их формулы записывают N2H4 · HCl, N2H4 · H2SO4 и т. д. и называют гидрохлорид гидразина, сульфат гидразина и т. д. Большинство таких солей растворимо в воде.
-
- N2H4 + HCl → [N2H5]Cl
Соли гидразина бесцветны, почти все хорошо растворимы в воде. К числу важнейших относится сульфат гидразина N2H4 · H2SO4.
гидразин как восстановитель
гидразин — энергичный восстановитель. В растворах гидразин обычно также окисляется до азота:
-
- 4KMnO4 + 5N2H4 + 6H2SO4 ⟶ 5N2 + 4MnSO4 + 2K2SO4 + 16H2O
Восстановить гидразин до аммиака можно только сильными восстановителями, такими, как Sn2+, Ti3+, водородом в момент выделения (Zn + HCl):
-
- N2H4 + Zn + 4HCl ⟶ 2NH4Cl + ZnCl2
Окисляется кислородом воздуха до азота, аммиака и воды. Известны многие органические производные гидразина. гидразин, а также гидразин-гидрат, гидразин-сульфат, гидразин-хлорид, широко применяются в качестве восстановителей золота, серебра, платиновых металлов из разбавленных растворов их солей. Медь в аналогичных условиях восстанавливается до закиси.
В органическом синтезе гидразин применяется для восстановления карбонильной группы альдегидов и кетонов до метиленовой по Кижнеру — Вольфу (реакция Кижнера — Вольфа), реакция идёт через образование гидразонов, расщепляющихся затем под действием сильных оснований.
Обнаружение
Качественной реакцией на гидразин служит образование окрашенных гидразонов с некоторыми альдегидами, в частности — с p-диметиламинобензальдегидом.
Получение
гидразин получают окислением аммиака NH3 или мочевины CO(NH2)2 гипохлоритом натрия NaClO (метод Рашига):
реакция проводится при температуре 160 °C и давлении 2,5—3,0 МПа.
Синтез гидразина окислением мочевины гипохлоритом по механизму аналогичен синтезу аминов из амидов по Гофману:
-
- (NH2)2CO + NaClO + 2NaOH ⟶ N2H4 + H2O + NaCl + Na2CO3
реакция проводится при температуре ~100 °C и атмосферном давлении.
Применяется также метод Байера:
Применение
гидразин применяют в органическом синтезе, в производстве пластмасс, резины, инсектицидов, взрывчатых веществ, в качестве компонента ракетного топлива, как восстановитель при выделении золота из растворов.
Гидразина сульфат применяется в случае таких заболеваний, как неоперабельные прогрессирующие распространённые формы, рецидивы и метастазы злокачественных опухолей — рак лёгкого (особенно немелкоклеточный), молочных желёз, желудка, поджелудочной железы, гортани, эндометрия, шейки матки, десмоидный рак, саркома мягких тканей, фибросаркома, нейробластома, лимфогранулематоз, лимфосаркома (монотерапия или в составе полихимиотерапии).
гидразин также применяется в качестве топлива в гидразин-воздушных низкотемпературных топливных элементах.
Жидкая смесь гидразина и нитрата аммония используется как мощное взрывчатое средство с нулевым кислородным балансом — астролит, который, однако, в настоящее время практического значения не имеет.
гидразин широко применяется в химической промышленности в качестве восстановителя кислорода, содержащегося в деминерализованной воде, применяемой для питания котлов (котельные установки, производства аммиака, слабой азотной кислоты и другое). При этом протекает следующая химическая реакция:
-
- N2H4 + O2 ⟶ N2 + 2H2O
Ракетное топливо
Во время Второй мировой войны гидразин применялся в Германии в качестве одного из компонентов топлива для реактивных истребителей «Мессершмитт Ме-163» (C-Stoff, содержащий до 30 % гидрата гидразина).
гидразин и его производные (метилгидразин, несимметричный диметилгидразин и их смеси (аэрозин)) широко распространены как ракетное горючее. Они могут быть использованы в паре с самыми разными окислителями, а некоторые и в качестве однокомпонентного топлива, в этом случае рабочим телом двигателя являются продукты разложения на катализаторе. Последнее удобно для маломощных двигателей.
| Окислитель | Удельная тяга (P1, с*) | Температура сгорания °C | Плотность топлива г/см³ | Прирост скорости, ΔVид, 25, м/с | Весовое содержание горючего % |
|---|---|---|---|---|---|
| Фтор | 364,4 с | °C | 1,314 | 5197 м/с | 31 % |
| Тетрафторгидразин | 334,7 с | °C | 1,105 | 4346 м/с | 23,5 % |
| ClF3 | 294,6 с | °C | 1,507 | 4509 м/с | 27 % |
| ClF5 | 312,0 с | °C | 1,458 | 4697 м/с | 26,93 % |
| Перхлорилфторид | 295,3 с | °C | 1,327 | 4233 м/с | 40 % |
| Фторид кислорода | 345,9 с | °C | 1,263 | 4830 м/с | 40 % |
| Кислород | 312,9 с | °C | 1,065 | 3980 м/с | 52 % |
| Пероксид водорода | 286,9 с | °C | 1,261 | 4003 м/с | 33 % |
| N2O4 | 291,1 с | °C | 1,217 | 3985 м/с | 43 % |
| Азотная кислота | 279,1 с | °C | 1,254 | 3883 м/с | 40 % |
- Удельная тяга равна отношению тяги к весовому расходу топлива; в этом случае она измеряется в секундах (с = Н·с/Н = кгс·с/кгс). Для перевода весовой удельной тяги в массовую её надо умножить на ускорение свободного падения (примерно равное 9,81 м/с²). В ракетно-космической сфере для обозначения чаще используют термин «удельный импульс тяги» (выражаемый в м/с) или просто «удельный импульс» (в секундах). Выраженная в м/с, эта величина характеризует скорость истечения реактивной струи (приблизительно, с учётом дополнительного слагаемого в формуле тяги ЖРД). Удельный импульс является важнейшей характеристикой совершенства ракетных двигателей. Зависит от типа применяемой топливной пары, схемы и конструкции двигателя и других параметров.
Токсичность
гидразин и большинство его производных очень токсичны. Небольшие концентрации гидразина вызывают раздражение глаз, дыхательных путей. При повышении концентрации начинается головокружение, головная боль и тошнота. Далее следуют судороги, токсический отёк лёгких, а за ними — кома и смерть. ПДК в воздухе рабочей зоны = 0,1 мг/м3. Относится к первому классу опасности


