Актиноиды
| Актиноиды | |
|---|---|
 Металлический уран |
|
| Состав группы | торий, Протактиний, уран, нептуний, плутоний, америций, кюрий, берклий, калифорний, эйнштейний, фермий, менделевий, нобелий, лоуренсий |
| Период открытия | XVIII век (уран) — XX век (лоуренсий) |
| Нахождение в природе | очень малое |
| Электронная конфигурация |
Список
Торий — [Rn] 6d2 7s2
Протактиний — [Rn] 5f2 6d1 7s2 Уран — [Rn] 5f3 6d1 7s2 Нептуний — [Rn] 5f4 6d1 7s2 Плутоний — [Rn] 5f6 7s2 Америций — [Rn] 5f7 7s2 Кюрий — [Rn] 5f7 6d1 7s2 Берклий — [Rn] 5f9 6d0 7s2 Калифорний — [Rn] 5f10 7s2 Эйнштейний — [Rn] 5f11 7s2 Фермий — [Rn] 5f12 7s2 Менделевий — [Rn] 5f13 7s2 Нобелий — [Rn] 5f14 7s2 Лоуренсий — [Rn] 5f147s27p1 |
| Нахождение группы в электронных блоках | f-блок |
| Токсичность | высокорадиоактивные элементы |
Актиноиды (актиниды) — семейство, состоящее из 15 радиоактивных химических элементов III группы 7-го периода периодической системы с атомными номерами 89—103.
Данная группа состоит из тория, протактиния, урана, нептуния, плутония, америция, кюрия, берклия, калифорния, эйнштейния, фермия, менделевия, нобелия и лоуренсия. Актиний часто для удобства сравнения рассматривается вместе с этими элементами, однако к актиноидам он не относится. Термин «Актиноиды» был предложен Виктором Гольдшмидтом в 1937 году.
| ** | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr |
Содержание
- 1 Изучение и синтез
- 1.1 От актиния до нептуния
- 1.2 От плутония
- 2 Изотопы
- 3 Распространение в природе
- 4 Получение
- 5 Свойства
- 6 Соединения
- 6.1 Оксиды и гидроксиды
- 6.2 Соли кислот
- 7 Применение
- 8 Токсичность
- 9 Галерея
Изучение и синтез
Подобно лантаноидам, Актиноиды образуют семейство схожих по свойствам элементов. Из актиноидов выделяют две пересекающиеся группы: «трансурановые элементы» — все следующие в таблице Менделеева за ураном элементы и «трансплутониевые элементы» — все следующие за плутонием.
Обе группы не ограничиваются указанными рамками и при указании приставки «транс-» могут включать в себя следующие за лоуренсием элементы — резерфордий и т. д. По сравнению с лантаноидами, которые (кроме прометия) обнаружены в природе в заметных количествах, Актиноиды труднее синтезировать. Но есть и исключения, например, легче всех синтезировать или найти в природе уран и торий, затем следуют плутоний, Протактиний, актиний и только потом сверхредкие кюрий, америций, нептуний, берклий и калифорний.
В настоящее время для получения изотопов трансплутониевых элементов (ТПЭ) используются два основных способа: облучение более лёгких элементов нейтронами или ускоренными заряженными частицами. Первый способ является практически наиболее важным, так как только в ядерных реакторах при облучении исходного материала большим потоком нейтронов возможно получить весовые количества трансплутониевых элементов. Преимущество второго способа в том, что он позволяет получать следующие за плутонием элементы, и нейтронодефицитные изотопы, которые не образуются при нейтронном облучении.
В 1962—1966 годах в США была произведена попытка синтеза трансплутониевых изотопов посредством 6 подземных ядерных взрывов — «Анакостиа», «Кеннебек», «Энчови», «Пар», «Барбел» и «Цикламен». Для изучения продуктов взрыва использовались небольшие образцы пород, добытые из зоны взрыва сразу же после его проведения. При этом не удалось обнаружить изотопы тяжёлых элементов с массовым числом больше 257, хотя для них были предсказаны в то время относительно большие величины T½ для α-распада. Возможно, это произошло потому, что атомы с большой скоростью спонтанно делились, или из-за другого характера распада промежуточных изотопов (испускание нейтронов, деление).
От актиния до нептуния
Первыми открытыми актиноидами были уран и торий. Уран открыл М. Клапрот в 1789 году в урановой смоляной руде (название элемента происходит от названия планеты Уран). М. Клапрот, восстанавливая углём жёлтый оксид урана, добыл чёрное вещество, которое ошибочно принял за металл. Только через 60 лет французский исследователь Эжен Пелиго изучил его и понял, что это вещество — диоксид урана. Тогда же была неправильно вычислена атомная масса — 120. Только Д. И. Менделеев в 1872 году на основании открытого им закона уточнил атомную массу урана — 240. Экспериментально эту величину подтвердил в 1882 году К. Циммерман.
Торий открыл Ф. Вёлер в минерале, который был найден в Норвегии (1827 год). Детально изучил этот элемент Й. Берцелиус; он же назвал его в честь скандинавского бога грома и молнии — Тора (1828 год).
Актиний был открыт в 1899 году помощником М. Склодовской-Кюри А. Дебьерном в отходах от переработки урановой смолки, из которой предварительно были удалены радий и полоний; он был выявлен во фракции, в которой при переработке руды концентрируются Лантаноиды. Название элемента «актиний» происходит от лат. actis — луч, сияние. Данный металл был открыт не по его собственному излучению, а по излучению дочерних продуктов распада.
| Получение трансурановых элементов | ||
|---|---|---|
| Элемент | Год открытия | Способ получения |
| Нептуний | 1940 | Бомбардировка 238U нейтронами |
| Плутоний | 1941 | Бомбардировка 238U дейтронами |
| Америций | 1944 | Бомбардировка 239Pu нейтронами |
| Кюрий | 1944 | Бомбардировка 239Pu α-частицами |
| Берклий | 1949 | Бомбардировка 241Am α-частицами |
| Калифорний | 1950 | Бомбардировка 242Cm α-частицами |
| Эйнштейний | 1952 | Обнаружен в продуктах термоядерного взрыва |
| Фермий | 1952 | Обнаружен в продуктах термоядерного взрыва |
| Менделевий | 1955 | Бомбардировка 253Es α-частицами |
| Нобелий | 1965 | Бомбардировка 243Am ядрами 15N |
| Лоуренсий | 1961—1971 | Бомбардировка 252Cf ядрами 10B и др. |
Из-за высокого сходства актиния и лантана и незначительного распространения актиния долгое время не удавалось выделить его в чистом виде. Чистый актиний был добыт лишь в 1950 году. Для элемента на данный момент известны 31 изотоп с массовыми числами 206—236 и 8 возбуждённых изомерных состояний некоторых его нуклидов. Наиболее стабильным является изотоп актиния 227Ac, который имеет период полураспада T½ = 21,77 года.
В 1917 году долгоживущий изотоп протактиния открыли О. Ган и Л. Мейтнер. Название «Протактиний» означает, что атом этого элемента способен образовывать актиний. На данный момент известны 29 изотопов протактиния с массовыми числами 212—240 и 3 возбуждённых изомерных состояния некоторых его нуклидов. Наиболее стабилен нуклид 231Pa, период полураспада которого равен 3,28⋅104 лет.
Большинство трансурановых элементов уже в достаточной мере изучены, но говорить о производственных количествах данных элементов, исключая плутоний и америций, и их соединений не приходится.
Первым предположил существование трансурановых элементов Энрико Ферми, что явилось результатом ряда его экспериментов в 1934 году.
Синтез изотопа нептуния 239Np, который провели в мае 1940 года Э. Мак-Миллан и Ф. Абельсон, положил начало открытию трансурановых элементов. В последующие года был произведен ядерный синтез других изотопов нептуния.
Актиноиды на протяжении последних десятилетий досконально изучались Г. Сиборгом и его школой. При участии Сиборга был произведён синтез большинства трансурановых элементов.
От плутония
Трансурановые элементы в природе практически не встречаются. Для их получения используют ядерные реакции, которые проходят в ядерных реакторах. Так, например, уран-238 в реакторе под действием нейтронов частично преобразуется в плутоний-239. При этом происходят следующие реакции:
При дальнейшем поглощении нейтронов 239Pu превращается в 241Pu, который вследствие β-распада переходит в 241Am.
Таким способом Энрико Ферми с сотрудниками в первом в мире реакторе «Чикагская поленница-1» впервые получил значительные количества плутония-239, которые были использованы для создания ядерного оружия.
Актиноиды с наибольшими порядковыми номерами получены при бомбардировании ядер урана, плутония, кюрия или калифорния ионами азота, кислорода, углерода, неона, бора на ускорителях тяжёлых ионов. Так, один из первых методов синтеза нобелия — бомбардировка мишени из урана-238 ядрами неона-22 в реакции
- 238
92U + 22
10He⟶ 256
102No + 41
0n.
Первые изотопы ТПЭ — америций-241 и кюрий-242 — были синтезированы в 1944 году Г. Сиборгом, Джеймсом и А. Гиорсо. Изотопы кюрия были получены при бомбардировке ядер плутония-239 ионами гелия с энергией 32 МэВ:
- 239
92U + 4
2He ⟶ 242
96Cm + 1
0n.
Также изотопы америция-241 и кюрия-242 были выделены из плутония, облучённого нейтронами в реакторе, где они образовались в результате ядерных превращений.
При бомбардировании кюрия-242 α-частицами образуется изотоп калифорния 245Cf. С помощью аналогичной реакции из америция-241 был получен берклий-244.
В 1945 году Кеннингем впервые выделил твёрдое соединение одного из ТПЭ — гидроксид америция. В течение последующих 3—4 лет были накоплены миллиграммовые количества америция и микрограммовые количества кюрия, что позволило, в результате облучения америция и кюрия, синтезировать изотопы берклия (Томсон, 1949 год) и калифорния (Томсон, 1950 год). Весовые количества данных элементов были выделены значительно позже, в 1958 году (Кеннингем и Томсон), а первое соединение калифорния (CfOCl) получено лишь в 1960 году (Кеннингем и Уолмен).
Эйнштейний и фермий были выделены группой американских учёных из Калифорнийского университета, Аргоннской национальной лаборатории и Лос-Аламосской научной лаборатории в 1952—1953 годах из продуктов термоядерного взрыва «Майк», произведённого 1 ноября 1952 года. В результате мгновенного облучения урана-238 большим потоком нейтронов, возникшим при термоядерном взрыве, образовались тяжёлые изотопы урана, в том числе уран-253 и уран-255, при β-распаде которых в конечном итоге образовались изотопы эйнштейния-253 и фермия-255. Эйнштейний был найден группой американских учёных во главе с А. Гиорсо в 1952 году и назван в честь великого физика — А. Эйнштейна. Фермий впервые был идентифицирован американским учёным А. Гиорсо в 1953 году в виде изотопа фермия-255, указанного выше. Фермий назван в честь физика Э. Ферми, внёсшего большой вклад в развитие современной теоретической и экспериментальной физики. Первые весовые (субмикрограммовые) количества эйнштейния выделены в 1961 году Кеннингемом и сотрудниками. Фермий и более ТПЭ с бо́льшими порядковыми номерами до настоящего времени не получены в весовых количествах.
Первый изотоп менделевия 256Md был синтезирован в феврале 1955 года (Г. Сиборг и сотрудники) при облучении эйнштейния-253 ионами гелия. Для синтеза следующих за менделевием элементов пришлось использовать новый метод — облучение ядер урана и трансурановых элементов тяжёлыми многозарядными ионами. Ввиду исключительно малого выхода и коротких периодов полураспада изотопов трансменделевиевых элементов, синтезируемых в этих реакциях, их идентификация оказалась очень сложной и не всегда надёжной. Как правило, в первых работах по синтезу элементов с Z⩾102 полученные изотопы идентифицировались чисто физическими методами, по характеру излучения и дочерним продуктам распада.
Попытки получения изотопов нобелия велись с 1957 года, но первым надёжным результатом следует считать синтез изотопа нобелия 256No, который был проведён Г. Флёровым в 1963 году. Для получения данного изотопа использовался неон-22.
В 1961 году А. Гиорсо и сотрудниками был получен первый изотоп лоуренсия путём облучения калифорния (в основном калифорния-252) ионами бора-10 и бора-11; массовое число этого изотопа не было точно установлено (возможно, 258 или 259) на тот момент. Более надёжно идентифицирован изотоп лоуренсия 256Lr, синтезированный в 1965 году Г. Флёровым с помощью нуклидов 243Am и 18O.
Изотопы
| Ядерные свойства важнейших изотопов трансплутониевых элементов | ||||||
|---|---|---|---|---|---|---|
| Изотоп | Период полураспада | Вероятность спонтанного деления, % | Энергия излучения, МэВ (выход, в %) | Удельная активность | ||
| α | γ | α, β-частицы, Бк/кг | деления, Бк/кг | |||
| 241Am | 432,2(7) лет | 4,3(18)⋅10−10 | 5,485 (84,8) 5,442 (13,1) 5,388 (1,66) |
0,059 (35,9) 0,026 (2,27) |
1,27⋅1014 | 546,1 |
| 243Am | 7,37(4)⋅103 лет | 3,7(2)⋅10−9 | 5,275 (87,1) 5,233 (11,2) 5,181 (1,36) |
0,074 (67,2) 0,043 (5,9) |
7,39⋅1012 | 273,3 |
| 242Cm | 162,8(2) суток | 6,2(3)⋅10−6 | 6,069 (25,92) 6,112 (74,08) |
0,044 (0,04) 0,102 (4⋅10−3) |
1,23⋅1017 | 7,6⋅109 |
| 244Cm | 18,10(2) года | 1,37(3)⋅10−4 | 5,762 (23,6) 5,804 (76,4) |
0,043 (0,02) 0,100 (1,5⋅10−3) |
2,96⋅1015 | 4,1⋅109 |
| 245Cm | 8,5(1)⋅103 лет | 6,1(9)⋅10−7 | 5,529 (0,58) 5,488 (0,83) 5,361 (93,2) |
0,175 (9,88) 0,133 (2,83) |
6,35⋅1012 | 3,9⋅104 |
| 246Cm | 4,76(4)⋅103 лет | 0,02615(7) | 5,343 (17,8) 5,386 (82,2) |
0,045 (19) | 1,13⋅1013 | 2,95⋅109 |
| 247Cm | 1,56(5)⋅107 лет | — | 5,267 (13,8) 5,212 (5,7) 5,147 (1,2) |
0,402 (72) 0,278 (3,4) |
3,43⋅109 | — |
| 248Cm | 3,48(6)⋅105 лет | 8,39(16) | 5,034 (16,52) 5,078 (75) |
— | 1,40⋅1011 | 1,29⋅1010 |
| 249Bk | 330(4) суток | 4,7(2)⋅10−8 | 5,406 (1⋅10−3) 5,378 (2,6⋅10−4) |
0,32 (5,8⋅10−5) | 5,88⋅1016 | 2,76⋅107 |
| 249Cf | 351(2) год | 5,0(4)⋅10−7 | 6,193 (2,46) 6,139 (1,33) 5,946 (3,33) |
0,388 (66) 0,333 (14,6) |
1,51⋅1014 | 7,57⋅105 |
| 250Cf | 13,08(9) года | 0,077(3) | 5,988 (14,99) 6,030 (84,6) |
0,043 | 4,04⋅1015 | 3,11⋅1012 |
| 251Cf | 900(40) лет | ? | 6,078 (2,6) 5,567 (0,9) 5,569 (0,9) |
0,177 (17,3) 0,227 (6,8) |
5,86⋅1013 | — |
| 252Cf | 2,645(8) года | 3,092(8) | 6,075 (15,2) 6,118 (81,6) |
0,042 (1,4⋅10−2) 0,100 (1,3⋅10−2) |
1,92⋅1016 | 6,14⋅1014 |
| 254Cf | 60,5(2) суток | ≈100 | 5,834 (0,26) 5,792 (5,3⋅10−2) |
— | 9,75⋅1014 | 3,13⋅1017 |
| 253Es | 20,47(3) суток | 8,7(3)⋅10−6 | 6,540 (0,85) 6,552 (0,71) 6,590 (6,6) |
0,387 (0,05) 0,429 (8⋅10−3) |
9,33⋅1017 | 8,12⋅1010 |
| 254Es | 275,7(5) суток | < 3⋅10−6 | 6,347 (0,75) 6,358 (2,6) 6,415 (1,8) |
0,042 (100) 0,034 (30) |
6,9⋅1016 | — |
| 255Es | 39,8(12) суток | 0,0041(2) | 6,267 (0,78) 6,401 (7) |
— | 4,38⋅1017(β) 3,81⋅1016(α) |
1,95⋅1013 |
| 255Fm | 20,07(7) ч | 2,4(10)⋅10−5 | 7,022 (93,4) 6,963 (5,04) 6,892 (0,62) |
0,00057 (19,1) 0,081 (1) |
2,27⋅1019 | 5,44⋅1012 |
| 256Fm | 157,6(13) мин | 91,9(3) | 6,872 (1,2) 6,917 (6,9) |
— | 1,58⋅1020 | 1,4⋅1019 |
| 257Fm | 100,5(2) суток | 0,210(4) | 6,752 (0,58) 6,695 (3,39) 6,622 (0,6) |
0,241 (11) 0,179 (8,7) |
1,87⋅1017 | 3,93⋅1014 |
| 256Md | 77(2) мин | — | 7,142 (1,84) 7,206 (5,9) |
— | 3,53⋅1020 | — |
| 257Md | 5,52(5) ч | — | 7,074 (14) | 0,371 (11,7) 0,325 (2,5) |
8,17⋅1019 | — |
| 258Md | 51,5(3) суток | — | 6,73 | — | 3,64⋅1017 | — |
| 255No | 3,1(2) мин | — | 8,312 (1,16) 8,266 (2,6) 8,121 (27,8) |
0,187 (3,4) | 8,78⋅1021 | — |
| 259No | 58(5) мин | — | 7,455 (9,8) 7,500 (29,3) 7,533 (17,3) |
— | 4,63⋅1020 | — |
| 256Lr | 27(3) с | < 0,03 | 8,319 (5,4) 8,390 (16) 8,430 (33) |
— | 5,96⋅1022 | — |
| 257Lr | 646(25) мс | — | 8,796 (18) 8,861 (82) |
— | 1,54⋅1024 | — |
К 1982 году было известно 24 изотопа актиния, на данный момент известны 31 изотоп актиния и ещё 8 возбуждённых изомерных состояний некоторых его нуклидов. В природе были найдены три изотопа — 225Ac, 227Ac и 228Ac, остальные получаются искусственным путём. На практике применяют три природных изотопа. Актиний-225 является членом радиоактивного ряда нептуния; был впервые обнаружен в 1947 году в качестве продукта распада урана-233. Если выдержать 1 г урана-233 в течение года, то активность образовавшегося в образце 225Ac составит 1,8⋅106 распадов в минуту. Данный нуклид является α-излучателем с периодом полураспада 10 сут. Актиний-225 по сравнению с актинием-228 менее доступен, но в практическом отношении как радиоактивный индикатор является более перспективным.
Актиний-227 — член радиоактивного ряда урана-актиния. Встречается во всех урановых рудах, однако в малых количествах. На 1 г урана при радиоактивном равновесии приходится всего 2⋅10−10 г 227Ac. Период полураспада изотопа 227Ac составляет 21,77 лет.
Актиний-228 является членом радиоактивного ряда тория; был открыт О. Ганом в 1906 году. Данный изотоп образуется при распаде 228Ra. В 1 т тория содержится 5⋅10−8 г 228Ac. Изотоп является β−-излучателем с периодом полураспада 6,15 ч.
Из изотопов протактиния известны 29 нуклидов с массовыми числами 212—240 и 3 возбуждённых изомерных состояния некоторых его нуклидов. Из этого количества только два нуклида — 231Pa и 234Pa — встречаются в природе, остальные — синтезируются. Продолжительность жизни всех изотопов, за исключением протактиния-231, невелика. С практической точки зрения наиболее важными являются долгоживущий изотоп 231Pa и искусственный 233Pa. Протактиний-233 является промежуточным продуктом при получении урана-233, он же является наиболее доступным среди других искусственных изотопов протактиния. По своим физическим свойствам (период полураспада, энергия γ-излучения и др.) является удобным веществом для химических исследований. Благодаря данному изотопу было получено очень много ценных химических сведений по химии протактиния. Радиационная активность протактиния-233 составляет около 20 000 Ки. Протактиний-233 является β-излучателем с периодом полураспада 26,97 дня.
Уран имеет 25 его изотопов с массовыми числами 217—242. Для урана известно наличие 6 изомерных состояний некоторых его нуклидов. В природе в заметных количествах уран находится в виде трёх изотопов — 234U, 235U и 238U. Из всех остальных важнейшим является 233U, который получается как конечный продукт превращений при облучении 232Th замедленными нейтронами. Ядро 233U обладает эффективным поперечным сечением деления на тепловых нейтронах, по сравнению с 235U. Из большинства изотопов урана наиболее удобным для изучения химических свойств считается уран-238, так как период полураспада составляет 4,4⋅109 лет.
В наше время известно 19 изотопов нептуния с массовыми числами от 225 до 244. Для работы с изотопами обычно применяются долгоживущий 237Np (T½=2,20⋅106 лет) и короткоживущие 239Np, 238Np. Важнейшим из них является нептуний-237. Данный изотоп наиболее пригоден для исследования физических и химических свойств. Спектр данного изотопа является очень сложным и состоит из более 20 моноэнергетических линий. Применение больших количеств 239Np в химической лаборатории осложняется его высокой радиоактивностью.
Для большинства нуклидов нептуния с массовым числом от 231 до 241 разброс в значениях периода полураспада составляет от 7,3 мин (240mNp) до 2,2⋅106 лет.
Для изотопов америция на данный момент известно 16 нуклидов с массовыми числами от 232 до 248. Важнейшими из них являются 241Am и 243Am, оба являются альфа-излучателями; имеют мягкое, но интенсивное γ-излучение; оба они могут быть получены в изотопически чистом виде. Химические свойства америция были изучены в основном на 241Am, однако в дальнейшем стали доступны весовые количества 243Am, который более удобен для химических исследований, так как почти в 20 раз менее активен, чем америций-241. Недостатком изотопа 243Am является наличие короткоживущего дочернего изотопа нептуния-239, с которым приходится считаться при определении по γ-активности.
На данный момент известно 19 изотопов кюрия. Наиболее доступные из них — 242Cm, 244Cm являются α-излучателями, но имеют гораздо меньшие, чем у изотопов америция, периоды полураспада. У этих изотопов почти отсутствует γ-излучение, но зато заметным являются спонтанное деление и связанное с ним испускание нейтронов. Более долгоживущие изотопы кюрия(245—248Cm, все α-излучатели) образуются в виде смеси при облучении нейтронами плутония или америция. В этой смеси при не очень продолжительном облучении преобладает кюрий-246, а затем начинает накапливаться кюрий-248. Оба эти изотопа, особенно 248Cm, имеют большие периоды полураспада и гораздо более удобны для проведения химических исследований, чем 242Cm и 244Cm; однако они также обладают довольно большой скоростью спонтанного деления. Наиболее живущий изотоп кюрия — 247Cm — не образуется в больших количествах из-за сильного деления на тепловых нейтронах.
Для берклия известно 14 его изотопов с массовыми числами 238—252. Единственный доступный из них в больших количествах — 249Bk имеет сравнительно малый период полураспада (330 дней) и испускает в основном мягкие β-частицы, неудобные для регистрации. У него имеется также слабое альфа-излучение (1,45⋅10−3 % по отношению к β-излучению), которое иногда используется для определения этого изотопа. Известен долгоживущий изотоп берклия-247 с периодом полураспада 1380 лет, имеющий альфа-излучение, но пока он не получен в весовых количествах. Образование изотопа при нейтронном облучении плутония не происходит из-за β-стабильности изотопов кюрия с массовым числом меньше 248.
Изотопы калифорния с массовыми числами 237—256 образуются в ядерном реакторе, как и другие. Изотоп калифорния-253 является β-излучателем, а все остальные — α-излучателями. Кроме того, изотопы с чётными массовыми числами (250Cf, 252Cf и 254Cf) характеризуются большой скоростью спонтанного деления, особенно изотоп калифорния-254, у которого 99,7 % распадов происходит путём спонтанного деления. Стоит отметить изотоп калифорния-249, который обладает довольно большим периодом полураспада (352 года) и слабым спонтанным делением. У этого изотопа имеется и сильное γ-излучение, которое может значительно облегчить его идентификацию. Изотоп 249Cf не получается в больших количествах в ядерном реакторе вследствие медленного β-распада материнского изотопа 249Bk и большого сечения взаимодействия с нейтронами, однако он может быть накоплен в изотопически чистом виде как продукт β-распада предварительно выделенного 249Bk. Калифорний, выделенный из облучённого в реакторе плутония, содержит в основном изотопы 250Cf и 252Cf (при большом интегральном потоке нейтронов преобладает 252Cf), и работа с ним затруднена из-за мощного нейтронного излучения.
| Характеристики некоторых равновесных пар изотопов ТПЭ | ||||
|---|---|---|---|---|
| Материнский изотоп | T½ | Дочерний изотоп | T½ | ВУРР |
| 243Am | 7370 лет | 239Np | 2,35 дня | 47,3 дня |
| 245Cm | 8265 лет | 241Pu | 14 лет | 129 лет |
| 247Cm | 1,64⋅107 лет | 243Pu | 4,95 часа | 7,2 дня |
| 254Es | 270 дней | 250Bk | 3,2 часа | 35,2 часа |
| 255Es | 39,8 дня | 255Fm | 22 часа | 5 дней |
| 257Fm | 79 дней | 253Cf | 17,6 дня | 49 дней |
Известно 16 изотопов изотопов эйнштейния с массовыми числами от 241 до 257. Наиболее доступным из его изотопов является 253Es — α-излучатель с периодом полураспада 20,47 дней, имеющий относительное слабое γ-излучение и небольшую по сравнению с изотопами калифорния скорость спонтанного деления. При более длительном облучении в реакторе образуется также долгоживущий 254Es (T½=275,5 дней).
Из изотопов фермия известно 19 нуклидов с массовыми числами от 242—260. Изотопы 254Fm, 255Fm, 256Fm являются α-излучателями с короткими периодами полураспада (часы) и поэтому не могут быть выделены в весовых количествах. Но при более длительном и мощном облучении можно, по-видимому, ожидать накопления заметных количеств долгоживущего изотопа фермия-257 (T½=100 дней). Все изотопы фермия, в том числе и 257Fm, характеризуются очень большими скоростями спонтанного деления.
Для менделевия известно 15 нуклидов с массовыми числами от 245 до 260. Все исследования свойств изотопов менделевия проводились с 256Md, который распадается главным образом путём электронного захвата (α-излучение ≈ 10 %) с периодом полураспада 77 минут. Известен долгоживущий изотоп 258Md (T½=53 дня), он также является альфа-излучателем. Оба эти изотопа получают из изотопов эйнштейния (соответственно 253Es и 255Es), поэтому возможность получения изотопов менделевия ограничивается количеством имеющегося эйнштейния.
Долгоживущие изотопы нобелия имеют малые периоды полураспада; по аналогии, все последующие после актиноидов элементы имеют все меньшие (местами) периоды полураспада. Для этого элемента известно 11 его нуклидов с массовыми числами от 250 до 260, и 262. Изучение химических свойств нобелия и лоуренсия проводились с изотопами 255No (T½=3 мин.) и 256Lr (T½=35 сек.). Наиболее долгоживущий 259No (Т½≈1,5 часа) синтезирован в 1970 году в городе Оук-Ридж, США.
Распространение в природе
Торий и уран имеют самую высокую распространённость среди актиноидов; их атомные кларки равны 3⋅10−4 % и 2⋅10−5 % соответственно. В земной коре уран встречается в виде минеральной формы уранинита — U3O8 (смоляная руда, урановая смолка), а также карнотита — KUO2VO4·3H2O, отенита — Ca(UO2)2(PO4)2·nH2O и др. Два последних минерала имеют жёлтый цвет. Уран содержится также почти во всех минеральных формах редкоземельных минералов (фергюсонит, самарскит, эвксенит и др.).
Уран в природе встречается в виде изотопов 238U (99,2739 %), 235U (0,7204 %) и 234U (0,0057 %). Из них 238U имеет наибольший период полураспада (T½ = 4,51⋅109 лет).
Лидирующие по добыче урана страны:
- Канада;
- Австралия;
- Казахстан;
- Нигер;
- Россия.
Уран принадлежит к числу редких и рассеянных элементов. Содержание в земной коре урана составляет примерно 2⋅10−4 %. Общие запасы урана исчисляются миллионами тонн. Из минеральных форм урана известно около 200 минералов, большинство из них относится к оксидам переменного состава (см. выше: карнотит, отенит).
Наиболее богатыми торием минералами являются торианит (ThO2), торит (ThSiO4), монацит, шералит ((Th, Ca, Ce)(PO4,SiO4)), торогумит (Th(SiO4)1−x(OH)4x). Торий, также как и уран, сопровождается с минеральными формами почти всех редкоземельных элементов. Богатые месторождения монацитовых песков находятся в Индии, Бразилии, Австралии, Африке, Канаде, США и на Цейлоне.
Распространение актиния в земной коре очень мало (атомный кларк 5⋅10−15 %). Подсчитано, что общее распространение актиния в земной коре составляет 2600 т, в то время как, например, содержание радия равно 40 млн т. Актиний содержится в таких природных материалах, как сульфидные, силикатные, кислородсодержащие минералы; в природной воде — в ещё меньших количествах, по сравнению с урановыми рудами. Содержание актиния в большинстве природных объектов соответствует изотопному равновесию материнских изотопов 235U. Повышенным содержанием данного элемента обладают такие минералы, как молибденит, халькопирит, касситерит, кварц, пиролюзит и др. Актиний характеризуется невысокой миграционной способностью и перемещением, то есть распространение актиния меньше по сравнению с ураном.
Более распространённым является Протактиний, атомный кларк которого 10−12 %. Протактиний был найден в урановой руде в 1913 году К. Фаянсом и О. Герингом. Общее содержание протактиния в земной коре (литосфере) в соответствии с содержанием урана (изотопы протактиния образуются при распаде 235U) составляет 4,4⋅107 т. Содержание в горных породах вулканического происхождения составляет 0,8⋅10−6 г/т, а в железных метеоритах 0,02⋅10−6 г/т.
Период полураспада самого долгоживущего изотопа 237Np ничтожно мал по сравнению с возрастом Земли, поэтому в природных минералах нептуний практически не встречается. На Земле его нуклиды могут образоваться практически лишь с помощью ядерных реакций. Нептуний находится в минералах как промежуточный продукт распада других изотопов.
| Содержание плутония в урановых и ториевых рудах | ||||
|---|---|---|---|---|
| Руда | Местонахождение | Содержание урана, % |
Отношение 239Pu/руда (по массе) |
Отношение 239Pu/U (⋅1012) |
| Уранитит | Канада | 13,5 | 9,1⋅10−12 | 7,1 |
| Уранитит | Бельгийское Конго | 38 | 4,8⋅10−12 | 12 |
| Уранитит | Колорадо | 50 | 3,8⋅10−12 | 7,7 |
| Концентрат уранитита | Бельгийское Конго | 45,3 | 7⋅10−12 | 15 |
| Монацит | Бразилия | 0,24 | 2,1⋅10−14 | 8,3 |
| Монацит | Северная Каролина | 1,64 | 5,9⋅10−14 | 3,6 |
| Фергюсонит | — | 0,25 | <1⋅10−14 | <4 |
| Карнотит | — | 10 | <4⋅10−14 | <0,4 |
Наличие плутония в небольших количествах в минеральных формах урана было впервые установлено в 1942 году. Верхний предел распространённости на Земле 244Pu — самого долгоживущего из изотопов плутония — составляет 3⋅10−22 г/г. Известно, что настуран и карнотит, найденные в Канаде и в штате Колорадо, содержат небольшое количество α-излучающего изотопа плутония 239Pu. Было определено содержание плутония в ряде урановых руд, с последующим выделением плутония из отходов производства 239Pu. Ни в одной из этих минеральных форм (см. таблицу) не было выделено другого изотопа плутония, кроме плутония-239. В образцах лунного грунта плутоний не был обнаружен.
Однако выделение природного плутония даже из наиболее обогащённых этим элементом урановых руд непрактично и не сможет вытеснить искусственное получение данного элемента. На это указывает тот факт, что для выделения микрограммовых количеств плутония потребуется на каждый выделенный микрограмм плутония переработать 100 т рудного концентрата плутония.
Получение
В большинстве случаев для получения чистого вещества элементов применяют разложение химического соединения этого элемента, обычно путём реакции его оксида, фторида и т. д. с водородом. Однако этот метод неприменим к актиноидам, поскольку они встречаются очень редко в природе, и поэтому для их выделения применяются более сложные методы очистки соединений, а затем и получения элементов данной группы.
Чаще всего для выделения чистых соединений актиноидов используют фториды, поскольку они плохо растворяются в воде и могут быть легче удалены путём обменной реакции. Фториды актиноидов восстанавливают кальцием, магнием или барием, так как они сравнительно более активны по сравнению с третьей и последующими подгруппами. Например, металлический америций добывают действием на его трифторид парами бария:
- 2AmF3 + 3Ba →1150−1350∘C 3BaF2 + 2Am
Аналогично добывают и остальные. Плутоний выделяют из его тетрафторида (PuF4), восстанавливая его:
- PuF4 + 2Ba →1200∘C 2BaF2 + Pu
Металлический уран также добывают из тетрафторида (UF4), но в качестве восстановителя используют магний:
- UF4 + 2Mg →>500∘C U + 2MgF2
Среди актиноидов наиболее легко добываются торий и уран. Торий добывают преимущественно из монацита. При этом дифосфат тория (Th(PO4)2) с примесями редкоземельных элементов, которые осаждаются при повышенном pH сульфатного раствора, обрабатывают азотной кислотой, а нитрат тория экстрагируют трибутилфосфатом. Ещё лучше из кислых растворов торий отделяется от РЗЭ в присутствии роданид-ионов.
При переработке монацита разложением 45%-го раствора гидроксида натрия (при 140 °С) сначала добывают гидроксиды смешанных металлов, которые затем отфильтровывают (при 80 °C), промывают водой и растворяют в концентрированной соляной кислоте. Далее кислый раствор нейтрализуют гидроксидами до pH=5,8. При этом оседает гидроксид тория (Th(OH)4) с примесями гидроксидов редкоземельных элементов (3 %), основная масса которых остается в растворе.
Гидроксид тория растворяют в неорганической кислоте и снова очищают от редкоземельных элементов. Более эффективным считается метод растворения гидроксида тория в азотной кислоте, потому что добытый раствор можно очистить посредством экстракции органическими растворителями:
- Th(OH)4 + 4HNO3 ⟶ Th(NO3)4 + 4H2O
Но в азотной кислоте ториевый концентрат не полностью растворяется. В хлороводороде он растворяется лучше, образуя хлорид тория и воду.
Можно отделить торий от редкоземельных элементов (когда их концентрация мала) осаждением оксалата тория из кислых растворов. Но самым перспективным считается метод экстрагирования солей тория органическими растворителями, которые не смешиваются с водой.
Металлический торий отделяют из безводного оксида, хлорида или фторида с помощью кальция в инертной атмосфере:
- ThO2 + 2Ca ⟶ 2CaO + Th − Q.
Иногда торий добывают электролизом нагретого фторида в смеси хлоридов натрия и калия. Электролиз проводят при 700—800 °С в графитовом тигле. Очень чистый торий добывают разложением его йодида с помощью метода Ван Аркеля и де бура.
Уран добывают из его руд разными способами. Сначала руду поджигают, затем воздействуют на неё кислотами, чтобы уран перешёл в растворённое состояние. При использовании серной кислоты, которая растворяет лишь соединения шестивалентного урана, нужно добавлять ещё и оксиды (MnO2, соли трёхвалентного железа и др.), чтобы перевести четырёхвалентный уран в шестивалентный. На следующей стадии уран отделяют из примесей. Для этого раствор отфильтровывают, а иногда непосредственно с пульпы экстрагируют соли урана органическими растворителями (диэтиловый эфир, трибутилфосфат). Из нитратного раствора лучше всего экстрагировать уран в керосиновом растворе ТБФ. При этом в органическую фазу переходит комплекс — UO2(NCS)2·2ТБФ.
Когда раствор, который состоит из солей урана, отфильтрован от нерастворимого осадка, уран можно выделить осаждением гидроксидами (в виде (NH4)2U2O7) или пероксидом водорода (в виде UO4·2H2O).
Если в урановой руде присутствует примесь таких минералов, как доломит, Магнезит и т. п., а они при действии кислоты на урановую руду нейтрализуют большое количество кислоты (реакция нейтрализации), целесообразнее использовать карбонатный способ разложения урановой руды. Основным реагентом для этого является водный раствор соды, который переводит уран в растворимое комплексное соединение — [UO2(CO3)3]4−. Данное соединение является стабильным в водных растворах при невысоких концентрациях гидроксид-ионов. Использование карбоната натрия имеет преимущество, потому что при его использовании, кроме урана, практически все другие металлы остаются в виде осадка. Преимущество карбонатного способа разложения урановых руд относительно кислотного состоит в отсутствии коррозийных характеристик рабочих растворов. Недостатком этого способа является то, что в присутствии карбоната натрия соединения четырёхвалентного урана не растворяются. Поэтому для полного очищения урана руду обрабатывают содой при нагревании и единовременной подачи под давлением кислорода:
- 2UO2 + O2 + 4HCO3− + 2CO32− ⟶ 2[UO2(CO3)3]4− + 2H2O.
Из данного уравнения видно, что наилучшим растворителем урана при карбонатной переработке является смесь карбоната с его бикарбонатом. Когда берется средний карбонат, то из-за высокого pH раствора часть урана может выпасть в осадок в виде диураната. Из карбонатных растворов диуранат выделяют, восстанавливая его водородом в присутствии никеля. При этом получается нерастворимый тетракарбонат урана.
Перспективным является также способ с использованием высокополимерных смол в качестве полиэлектролитов. В смолах происходит обмен ионов, в результате чего выделяется уран. С помощью данного способа можно выделить уран как из кислых, так и из осно́вных (карбонатных) растворов. Поскольку, по сравнению с остальными трансурановыми металлами, уран легче создает анионные комплексы, например [UO2(SO4)2]2−, [UO2(CO3)3]4−, то при выделении в реакции ионного обмена урана лучше пользоваться анионитами с четвертинными аммонийными группами R4N+A−.
Из анионита уран вымывают раствором нитрата аммония или азотной кислоты.
После разделения уран выделяют в виде нитрата уранила — UO2(NO3)2·6H2O. Из него при нагревании получится оксид урана (VI), который при восстановлении водородом переходит в диоксид:
- UO3 + H2 ⟶ UO2 + H2O
При действии фтороводорода на диоксид урана добывают тетрафторид урана, который потом можно восстановить магнием до металлического урана:
- 4HF + UO2 ⟶ UF4 + 2H2O
- UF4 + 2Mg →>500∘C U + 2MgF2
Для выделения плутония из продуктов расщепления радиоактивных материалов облучённый нейтронами уран растворяют в азотной кислоте. К полученному раствору добавляют восстановитель (FeSO4, или H2O2), который переводит плутоний из степени окисления +6 в +4, а уран остается в виде нитрата уранила (UO2(NO3)2). После обработки восстановителем раствор нейтрализуют карбонатом аммония до pH=8. При этом Pu4+ переходит в осадок.
Можно воспользоваться и другим методом. После восстановления нитратного раствора газообразной серой добавляют плавиковую кислоту и осаждают ионы лантана, а вместе с этим осаждаются и фториды плутония и нептуния (M4+). После фильтрования и промывания осадок фторидов обрабатывают броматом калия для окисления нептуния до NpO22+, который переходит в раствор. Далее с помощью более сильных окислителей переводят плутоний в Pu6+ и тем самым отделяют его от лантаноидов.
Часто для разделения плутония и других актиноидов, начиная с урана, пользуются экстракцией трибутилфосфатом. Сначала экстрагируют нитраты Pu4+ и U6+, а потом экстрагент приводят в контакт с гидразином и вымывают восстановленный плутоний.
Препараты, содержащие актиний, бывают загрязнены редкоземельными элементами. Сложность очистки актиния осложняется сходством актиния и лантана, что осложняет отделение актиния. Актиний можно получить несколькими способами — ядерными реакциями или методами отделения, осаждения или ионного обмена. В первом случае применяется ядерная реакция с участием изотопов радия. Во втором случае применяются химические методы получения актиния — реакции ионного обмена, очистка от примесей с помощью реакций. Существует, помимо вышеописанных методов отделения актиния от примесей, и методы хроматографии, методы экстракции, электрохимии и другие способы, также применимые к остальным актинидам.
Свойства
По свойствам Актиноиды сходны с лантаноидами, но между ними есть и отличия. Отличие двух групп объясняется тем, что у актиноидов прерывается заполнение наружных электронных оболочек — шестой (группа 6d) и седьмой (после появления группы электронов 7s2), и при переходе от каждого предыдущего актиноида к последующему происходит (в основном, а начиная с кюрия — исключительно) заполнение f-электронов в пятой электронной оболочке. У актиноидов по аналогии с лантаноидами происходит заполнение f-слоя в четвёртой электронной оболочке.
Первое экспериментальное доказательство заполнения пятой f-электронной оболочки в области близких к урану тяжёлых элементов было получено Э. Макмилланом и Ф. Абельсоном в 1940 году.
Радиусы ионов актиноидов, подобно ионам лантаноидов, с увеличением порядковых номеров элементов монотонно уменьшаются. Актиноиды-ионы парамагнитны, причём величина грам-ионной магнитной способности для обоих типов катионов одинаково изменяется в зависимости от количества f-электронов.
| Свойства актиноидов | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Свойство | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr |
| Заряд ядра | 89 | 90 | 91 | 92 | 93 | 94 | 95 | 96 | 97 | 98 | 99 | 100 | 101 | 102 | 103 |
| Атомная масса | [227] | 232,038 | [231] | 238,029 | [237] | [244] | [243] | [247] | [247] | [251] | [252] | [257] | [258] | [259] | [262] |
| Число природных изотопов | 3 | 1 | 2 | 3 | — | — | — | — | — | — | — | — | — | — | — |
| Наиболее долгоживущий изотоп | 227 | 232 | 231 | 238 | 237 | 244 | 243 | 247 | 247 | 251 | 252 | 257 | 258 | 259 | 262 |
| Период полураспада наиболее долгоживущего изотопа | 21,8 лет | 14000 млн лет | 32500 лет | 4470 млн лет | 2,14 млн лет | 8,2 млн лет | 7370 лет | 15,6 млн лет | 1400 лет | 900 лет | 1,29 лет | 100,5 сут | 52 сут | 58 мин | 261 мин |
| Электронная конфигурация в основном состоянии | 6d17s2 | 6d27s2 | 5f26d17s2 или 5f16d27s2 | 5f36d17s2 | 5f46d17s2 или 5f57s2 | 5f67s2 | 5f77s2 | 5f76d17s2 | 5f97s2 или 5f86d17s2 | 5f107s2 | 5f117s2 | 5f127s2 | 5f137s2 | 5f147s2 | 5f146d17s2 |
| Степень окисления | 3 | 3, 4 | 3, 4, 5 | 3, 4, 5, 6 | 3, 4, 5, 6, 7 | 3, 4, 5, 6, 7 | 3, 4, 5, 6 | 3, 4 | 3, 4 | 2, 3 | 2, 3 | 2, 3 | 2, 3 | 2, 3 | 3 |
| Металлический радиус, нм | 0,203 | 0,180 | 0,162 | 0,153 | 0,150 | 0,162 | 0,173 | 0,174 | 0,170 | 0,186 | 0,186 | — | — | — | — |
| Ионный радиус, нм: M4+ M3+ |
— 0,126 |
0,114 — |
0,104 0,118 |
0,103 0,118 |
0,101 0,116 |
0,100 0,115 |
0,099 0,114 |
0,099 0,112 |
0,097 0,110 |
0,096 0,109 |
0,085 0,098 |
0,084 0,091 |
0,084 0,090 |
0,084 0,095 |
0,083 0,088 |
| Температура, °C: плавления кипения |
1050 3300 |
1750 4800 |
1572 4400 |
1130 3800 |
640 3900 |
640 3230 |
1176 2610 |
1340 — |
1050 — |
900 — |
860 — |
1530 — |
830 — |
830 — |
1630 — |
| СЭП, B: E°(M4+/M0) E°(M3+/M0) |
— −2,13 |
−1,83 — |
−1,47 — |
−1,38 −1,66 |
−1,30 −1,79 |
−1,25 −2,00 |
−0,90 −2,07 |
−0,75 −2,06 |
−0,55 −1,96 |
−0,59 −1,97 |
−0,36 −1,98 |
−0,29 −1,96 |
— −1,74 |
— −1,20 |
— −2,10 |
| Окраска: [M(H2O)n]4+ [M(H2O)n]3+ |
— Бесцветная |
Бесцветная Синяя |
Жёлтая Тёмно-синяя |
Зелёная Пурпурная |
Жёлто-зелёная Пурпурная |
Коричневая Фиолетовая |
Красная Розовая |
Жёлтая Бесцветная |
Бежевая Жёлто-зелёная |
Зелёная Зелёная |
— Розовая |
— — |
— — |
— — |
— — |
| Степень окисления | 89 | 90 | 91 | 92 | 93 | 94 | 95 | 96 | 97 | 98 | 99 |
| +3 | Ac3+ | Th3+ | Pa3+ | U3+ | Np3+ | Pu3+ | Am3+ | Cm3+ | Bk3+ | Cf3+ | Es3+ |
| +4 | Th4+ | Pa4+ | U4+ | Np4+ | Pu4+ | Am4+ | Cm4+ | Bk4+ | Cf4+ | ||
| +5 | PaO2+ | UO2+ | NpO2+ | PuO2+ | AmO2+ | ||||||
| +6 | UO22+ | NpO22+ | PuO22+ | AmO22+ | |||||||
| +7 | NpO23+ | PuO23+ | [AmO6]5− |
Физические свойства
С физической точки зрения Актиноиды — типичные металлы. Все они мягкие, имеют серебристый цвет, достаточно высокую плотность и пластичность. Некоторые из этих металлов можно разрезать ножом. Торий по твёрдости подобен мягкой стали. Из нагретого чистого тория можно раскатывать листы, вытягивать проволоку. Торий почти вдвое легче урана и плутония, но твёрже их обоих. Все Актиноиды в той или иной степени радиоактивны. Из них только торий и уран встречаются в природе в заметных количествах.
| Физические свойства некоторых актиноидов | |||||
|---|---|---|---|---|---|
| Название металла | Плотность, г/см³, при 25 °C |
Температура плавления, °С | Цвет | Поперечное сечение захвата нейтронов, барн |
Радиус атома, Å |
| Актиний | 10 | 1050 | Серебристо-белый | — | 1,88 |
| Торий | 11,7 | 1750 | Серебристо-белый | 7,57 | 1,798 |
| Протактиний | 15,4 | 1572 | Серебристо-белый | — | 1,774 |
| Уран | 19,1 | 1135 | Серебристо-белый | 7,68 (природная смесь) | 1,762 |
| Нептуний | 20,2 | 644 | Серебристый | — | 1,759 |
| Плутоний | 19,7 | 640 | Серебристо-белый | — | 1,58 |
| Америций | 12 | 1176 | Серебристый | — | 1,82 |
| Кюрий | 13,51 | 1345 | Серебристый | — | 1,74 |
| Берклий | 13,25 | 986 | Серебристо-белый | — | 1,70 |
| Калифорний | 15,1 | 900 | Серебристо-белый | — | — |
| Эйнштейний | — | 860 | Серебристый | — | — |
| Фермий | — | 1527 | — | — | — |
| Менделевий | — | 827 | — | — | — |
| Нобелий | — | 827 | — | — | — |
| Лоуренсий | — | 1627 | — | — | — |
Для всех актиноидов, кроме актиния, характерен полиморфизм.
-
![Монацит]()
Фазовая диаграмма актинидов
Плутоний имеет семь полиморфных модификаций, а уран, нептуний и калифорний — три. Кристаллические структуры протактиния, урана, нептуния и плутония по своей сложности не имеют аналогов среди лантаноидов и более похожи на структуры 3d-переходных металлов. Лёгкие Актиноиды в точке плавления имеют объёмно-центрированную решётку, а начиная с плутония — гранецентрированную.
Температура плавления актиноидов изменяется при увеличении числа f-электронов нелинейно. С ростом числа данных электронов температура плавления сначала (от протактиния к плутонию) понижается, а затем (от америция к кюрию) повышается. Уникально низкую температуру плавления у плутония объясняют гибридизацией 5f- и 6d-орбиталей и образованием направленных связей в этих металлах. От кюрия до эйнштейния температура плавления снова понижается, а затем возрастает до максимума у фермия. Аналогичная кривая температур плавления повторяется от фермия до лоуренсия.
Для актиноидов от америция до эйнштейния при любых температурах ниже температуры плавления характерны гранецентрированная кубическая и гексагональная плотнейшие упаковки. Для трансурановых элементов сходство с металлическими лантаноидами усиливается — при комнатной температуре кристаллические структуры актиноидов от америция до калифорния и лёгких лантаноидов аналогичны.
| Сравнительная характеристика радиусов ионов лантаноидов и актиноидов | ||||
|---|---|---|---|---|
| Лантаноиды | Радиусы ионов Ln3+, Å | Актиноиды | Радиусы ионов M3+, Å | Радиусы ионов M4+, Å |
| Лантан | 1,061 | Актиний | 1,11 | — |
| Церий | 1,034 | Торий | 1,08 | 0,99 |
| Празеодим | 1,013 | Протактиний | 1,05 | 0,93 |
| Неодим | 0,995 | Уран | 1,03 | 0,93 |
| Прометий | 0,979 | Нептуний | 1,01 | 0,92 |
| Самарий | 0,964 | Плутоний | 1,00 | 0,90 |
| Европий | 0,950 | Америций | 0,99 | 0,89 |
| Гадолиний | 0,938 | Кюрий | 0,98 | 0,88 |
| Тербий | 0,923 | Берклий | — | — |
| Диспрозий | 0,908 | Калифорний | — | — |
| Гольмий | 0,894 | Эйнштейний | — | — |
| Эрбий | 0,881 | Фермий | — | — |
| Тулий | 0,869 | Менделевий | — | — |
| Иттербий | 0,858 | Нобелий | — | — |
| Лютеций | 0,848 | Лоуренсий | — | — |
Химические свойства
Все Актиноиды являются химически активными металлами.
Подобно лантаноидам, 5f-элементы обладают высокой химической активностью по отношению к кислороду, галогенам, азоту, сере. Так, торий, уран и нептуний уже при комнатной температуре медленно окисляются на воздухе. Чистый плутоний, оставленный на воздухе является пирофорным.
Различие химических свойств актиноидов и лантаноидов проявляется в том, что Актиноиды легче вступают в реакции и имеют разные валентные состояния. Это объясняется меньшим размером 5f-орбиталей по сравнению с 4f-орбиталями, их экранированностью внешними электронами и поэтому способностью к более легкому расширению за пределы 6s- и 6p-орбиталей. Актиноиды склонны к гибридизации. Особенно это характерно для тех элементов, атомы которых имеют малое количество 5f-электронов. Объясняется это тем, что энергии 5f-, 7s- и 6d-подуровней очень близки.
Большинство элементов данной группы могут иметь разные степени окисления, причём в наиболее стабильных соединениях проявляются следующие степени окисления:
- актиний — +3;
- торий — +4;
- Протактиний — +5;
- уран — +6;
- нептуний — +5;
- плутоний — +4;
- америций и остальные Актиноиды — +3.
По химическим свойствам актиний напоминает лантан, что объясняется, в первую очередь, их сходными ионными радиусами. Подобно лантану, для актиния свойственна лишь степень окисления +3. Актиний в отличие от лантана проявляет более слабую реакционную способность и более ярко выраженные осно́вные свойства. Среди остальных трёхзарядных ионов Ac3+ выделяется присутствием наиболее слабых кислотных свойств, то есть актиний в водных растворах гидролизуется лишь в незначительной степени.
Торий характеризуется высокой химической активностью. Для тория, как и для элементов четвёртой группы, характерна степень окисления +4. Из-за отсутствия электронов на 6d- и 5f-орбиталях соединения четырёхвалентного тория не имеют окраски. В растворах солей тория при pH < 3 преобладают катионы [Th(H2O)8]4+. Ион Th4+ имеет необычайно большой радиус; в зависимости от координационного числа он может принимать значения от 0,95 до 1,14 Å. Именно с данной характерной особенностью связана низкая способность солей тория к гидролизу. Отличительной способностью солей тория считается их высокая растворимость не только в воде, но и в полярных органических растворителях.
Протактиний имеет два валентных состояния — 5 и 4. В отличие от стабильного пятивалентного состояния четырёхвалентный Протактиний в растворах чрезвычайно легко окисляется до Pa5+ кислородом воздуха. В связи с этим четырёхвалентный Протактиний в растворах получают действием сильных восстановителей в атмосфере водорода. Четырёхвалентный Протактиний по химическим свойствам является близким аналогом UIV и тория. Известно, что PaIV образует много кристаллических соединений, изоструктурных с соединениями UIV и тория. Фториды, фосфаты, гипофосфаты, иодаты и фениларсонаты PaIV нерастворимы в воде и в достаточно разбавленных кислотах. Протактиний образует растворимые карбонаты. По гидролитическим свойствам пятивалентный Протактиний близок к TaV и NbV. Сложность химического поведения протактиния является следствием появления у атомов данного элемента 5f-орбит.
Для урана, как и для многих d-элементов, характерно наличие нескольких степеней окисления, в частности, уран принимает значения валентности от 3 до 6, наиболее устойчивой степенью окисления является +6. В шестивалентном состоянии уран является полным электронным аналогом элементов шестой группы, хотя значительная разница в радиусах ионов U6+ и W6+ делает сходство между ними лишь формальным (однако они имеют одинаковые составы высших оксидов и некоторых оксоанионов, например UO22+). В соединениях уранаIV и уранаVI присутствует ряд нестехиометрических соединений, то есть оксиды переменного состава. К примеру, химическую формулу его диоксида — UO2 — правильнее записывать UO2+x, где x имеет значения от −0,4 до +0,32. Соединения уранаVI не являются сильными окислителями. Соединения уранаIV проявляют восстановительные свойства, например легко окисляются кислородом из воздуха. Соединения уранаIII являются очень сильными восстановителями. Уран склонен к образованию металлоорганических соединений. Данное свойство объясняется наличием d-орбитали.
Для нептуния возможны валентности 3, 4, 5, 6 и 7. В растворах он может находиться одновременно в нескольких из них. Это объясняется диспропорционированием пятивалентного нептуния в сильнокислых растворах из-за близости редокс-потенциалов ионных пар нептуния. Наиболее стабильными в растворах являются ионы NpV. В твёрдых соединениях нептуний устойчив и проявляет валентность 4. Ионы NpIII и NpIV, как и других актиноидов, существуют в воде в качестве гидратированных катионов вышеуказанных ионов нептуния. NpIII гидролизуется в слабощелочной среде. Металлический нептуний очень реакционноспособен. Ионы данного элемента отличаются высокой склонностью к образованию координационных соединений и гидролизу.
Для плутония, так же как и для нептуния, возможны валентности от 3 до 7. Химическое поведение плутония аналогично для урана и нептуния. В химическом отношении плутоний является весьма активным элементом. На воздухе он окисляется, образуя плёнку из PuO при 50 °C. Плутоний заметно реагирует с водородом даже при 25—50 °C. Металлический плутоний довольно активно взаимодействует с галогенами и галогеноводородами. Данный элемент обладает сильным потенциалом к образованию интерметаллических соединений. Реакции гидролиза ионов плутония разных степеней окисления довольно разнообразны. Для PuIV в зависимости от условий характерны реакции полимеризации.
Наибольшим разнообразием отличается америций, у которого достоверно установлено наличие степеней окисления от +2 до +6. Двухвалентный америций получен только в сухих соединениях и в неводных растворах (ацетонитриле). Состояния окисления +3, +5 и +6 характерны для водных растворов америция, хотя известно большое количество соответствующих им твёрдых соединений. Четырёхвалентный америций образует устойчивые твёрдые соединения (диоксид, фторид, гидроксид америция), в водном растворе он существует в виде различных комплексных соединений. Сообщалось, что в щелочном растворе америций может быть окислен до семивалентного состояния, однако эти данные оказались ошибочными. Наиболее устойчивой валентностью америция в водном растворе является +3, в твёрдых соединения +3 и +4.
Валентность +3 является доминирующей у всех последующих элементов вплоть до лоуренсия (за исключением, возможно, нобелия). Кюрий существует в четырёхвалентном состоянии в твёрдых соединениях (фторид, диоксид кюрия), а в водном растворе — только в виде неустойчивого фторидного комплексного соединения. Сообщалось об окисления кюрия в водном растворе до шестивалентного состояния, однако другие исследователи не смогли воспроизвести этот результат.
Берклий, наряду с валентностью +3, также проявляет валентность +4, более устойчивую чем у кюрия; ей отвечает ряд твёрдых соединений (фторид, диоксид берклия), а в водном растворе устойчивость иона Bk4+ близка к устойчивости иона Ce4+. У калифорния, эйнштейния и фермия единственной достоверной валентностью является +3. Доказано наличие двухвалентного состояния у менделевия и нобелия, причём у нобелия оно является более устойчивым, чем трёхвалентное. Валентности двух последних трансплутониевых элементов — лоуренсия и резерфордия — очень скудны; известно, что лоуренсий как в растворе, так и в сухих соединениях проявляет только валентность +3; а резерфордий в виде хлорида ведёт себя подобно гафнию, то есть, по-видимому, четырёхвалентен.
Из-за того что торий, Протактиний и уран имеют высокие стабильные степени окисления, их иногда ставят как элементы побочных подгрупп четвёртой, пятой и шестой групп. Если бы и действительно существовала такая тенденция, трансурановые элементы должны были бы находится в восьмой и седьмой группах, и у них легче, чем у урана, должна была бы проявляться высокая валентность. Но этого не наблюдается, потому что от урана до америция способность создавать соединения с валентностью +6 уменьшается. В этом можно убедиться, проставляя полученные в стандартных условиях редокс-потенциалы E=M4+\MO22+:
- уран: −0,32 В,
- нептуний: +0,34 В,
- плутоний: +1,04 В,
- америций: +1,34 В.
Отсюда напрашивается вывод, что восстановительная способность иона M4+ возрастает от америция до урана.
Как и Лантаноиды, все металлы-Актиноиды легко соединяются с кислородом, галогенами и халькогенами, углеродом, водородом и серой. Для америция установлено, что возможно получить гидрид данного вещества — AmH3. Торий, Протактиний и уран также соединяются с водородом при 250 °C. Создают гидриды и другие Актиноиды. Гидриды с общей формулой MH3 своими свойствами напоминают соли. Все соединения имеют чёрный цвет.
При реакции с углеродом Актиноиды преимущественно создают карбиды с общей формулой MC, MC2, а уран U2C3. С серой они производят сульфиды с общей формулой M2S3 и MS2.
Соединения
Оксиды и гидроксиды
Для некоторых актиноидов известно несколько оксидов: M2O3, MO2, M2O5 и MO3. Для всех металлов оксиды M2O3, MO2 и M2O5 — осно́вные, а MO3 — амфоте́рные. Более выражены основные свойства оксидов. Они легко соединяются с водой, образуя основания:
- M2O3 + 3H2O ⟶ 2M(OH)3.
Данные основания плохо растворяются в воде, а по своей активности близки к гидроксидам редкоземельных металлов. Наиболее сильным из этих оснований является гидроксид актиния. Актиний сравнительно легко взаимодействует с водой, вытесняя водород. Все соединения актиния, кроме его чёрного сульфида (Ac2S3), имеют белую окраску.
Оксиды четырёхвалентных актиноидов кристаллизуются в кубическую сингонию, структура кристалла типа флюорита (Фторид кальция).
- An — актиноид (-ы)
Торий, соединяясь с кислородом, образует лишь диоксид. Его можно получить при сжигании металлического тория в кислороде при температуре в 1000 °C, или нагреванием некоторых его солей:
- Th + O2 →1000∘C ThO2
Диоксид тория является тугоплавким веществом (температура плавления 3220 °C), очень стоек к нагреванию. Из-за этого свойства диоксид тория иногда используют в производстве огнеупорных материалов. Добавление 0,8—1 % ThO2 к чистому вольфраму стабилизирует его структуру; поэтому волоски электроламп имеют лучшую устойчивость при вибрациях.
Диоксид тория — основный оксид, но непосредственно при реакции металла с водой он не получится. Чтобы растворить ThO2 в кислотах его сначала нагревают до температуры 500—600 °C. Более сильное нагревание (выше 600 °C) способствует получению очень стойкой к кислотам и другим реагентам структуры ThO2. Небольшая добавка фторид-ионов катализирует растворение торий и его диоксида в кислотах.
У протактиния получено два оксида: PaO2 (чёрный) и Pa2O5 (белый). Первый из них изоморфен с ThO2. Легче получить Pa2O5. Оба оксида протактиния основные. Для пятивалентного протактиния можно получить Pa(OH)5 — слабое плохо растворимое основание.
При разложении некоторых солей урана можно получить оранжевый или жёлтый UO3. Данный оксид является амфотерным; он непосредственно получается при взаимодействии с водой и создает несколько гидроксидов, из которых наиболее стабильным является UO2(OH)2.
При реакции оксида урана(VI) с водородом получается диоксид урана, который схож по своим свойствам с ThO2. Этот оксид также является осно́вным. Ему соответствует тетрагидроксид урана (U(OH)4).
Плутоний, нептуний и америций образуют оксиды двух типов: M2O3 и MO2, которые обладают осно́вными свойствами. У кюрия получены белый Cm2O3 и чёрный CmO2, у калифорния — Cf2O3. Оксиды остальных актиноидов плохо изучены. Триоксид нептуния является менее стойким, чем оксид урана, поэтому он не получен в чистом виде (только Np3O8). В то же время, хорошо изучены оксиды плутония и нептуния с химической формулой MO2 и M2O3.
Оксиды новых элементов часто исследуются первыми, что связано с их большим значением, лёгкостью получения и с тем фактом, что оксиды обычно служат в качестве промежуточных соединений при получении других веществ.
| Оксиды актиноидов | |||||||
|---|---|---|---|---|---|---|---|
| Соединение | Цвет | Сингония и структурный тип | Параметры ячейки, Å | Плотность, г/см³ | Область существования, °C | ||
| a | b | c | |||||
| Ac2O3 | Белый | Гексагональная, La2O3 | 4,07 | — | 6,29 | 9,19 | — |
| PaO2 | — | Кубическая, CaF2 | 5,505 | — | — | — | — |
| Pa2O5 | Белый | Кубическая, CaF2 Квадратичная Тетрагональная Гексагональная Ромбоэдрическая Орторомбическая |
5,446 10,891 5,429 3,817 5,425 6,92 |
— — — — — 4,02 |
— 10,992 5,503 13,22 — 4,18 |
— | 700 700—1100 1000 1000—1200 1240—1400 — |
| ThO2 | Бесцветный | Кубическая | 5,59 | — | — | 9,87 | — |
| UO2 | Чёрно-коричневый | Кубическая | 5,47 | — | — | 10,9 | — |
| NpO2 | Зеленовато-коричневый | Кубическая, CaF2 | 5,424 | — | — | 11,1 | — |
| PuO | Чёрный | Кубическая, NaCl | 4,96 | — | — | 13,9 | — |
| PuO2 | Оливково-зелёный | Кубическая | 5,39 | — | — | 11,44 | — |
| Am2O3 | Красновато-коричневый Рыжевато-коричневый |
Кубическая, Mn2O3 Гексагональная, La2O3 |
11,03 3,817 |
— | — 5,971 |
10,57 11,7 |
— |
| AmO2 | Чёрный | Кубическая, CaF2 | 5,376 | — | — | — | — |
| Cm2O3 | Белый — — |
Кубическая, Mn2O2 Гексагональная, LaCl3 Моноклинная, Sm2O3 |
11,01 3,80 14,28 |
— — 3,65 |
— 6 8,9 |
11,7 | — |
| CmO2 | Чёрный | Кубическая, CaF2 | 5,37 | — | — | — | — |
| Bk2O3 | Светло-коричневый | Кубическая, Mn2O3 | 10,886 | — | — | — | — |
| BkO2 | Рыжевато-коричневый | Кубическая, CaF2 | 5,33 | — | — | — | — |
| Cf2O3 | Бесцветный Желтоватый — |
Кубическая, Mn2O3 Моноклинная, Sm2O3 Гексагональная, La2O3 |
10,79 14,12 3,72 |
— 3,59 — |
— 8,80 5,96 |
— | — |
| CfO2 | Чёрный | Кубическая | 5,31 | — | — | — | — |
| Es2O3 | — | Кубическая, Mn2O3 Моноклинная Гексагональная, La2O3 |
10,07 1,41 3,7 |
— 3,59 — |
— 8,80 6 |
— | — |
Соли кислот
Металлы-Актиноиды хорошо соединяются с галогенами, создавая соли MHa3 и MHa4 (Ha — галоген), так был получен хлорид калифорния. В 1962 году было синтезировано первое соединение берклия — BkCl3 в количестве 0,000003 мг.
Подобно галогенам редкоземельных элементов хлориды, бромиды и иодиды актиноидов растворяются в воде, а фториды — нерастворимы. У урана сравнительно легко получить бесцветный гексафторид, который способен возгоняться при температуре в 56,5 °C. Из-за лёгкости UF6 его применяют при разделении изотопов урана диффузным методом.
Гексафториды актиноидов по свойствам приближаются к ангидридам. В воде они гидролизуются, образуя MO2F2. Также были синтезированы пентахлорид и чёрный гексахлорид урана, но они оба являются нестабильными.
При воздействии кислот на актиний, торий, Протактиний, уран, нептуний и пр. получаются соли. В случае, если на них действовать кислотами-неокислителями, как правило, можно получить соли низкой валентности металлов:
- U + 2H2SO4 ⟶ U(SO4)2 + 2H2
- 2Pu + 6HCl ⟶ 2PuCl3 + 3H2
Однако в ходе данных реакций восстанавливающий водород может реагировать с самим металлом, образуя соответствующий гидрид металла. С кислотами и водой уран реагирует значительно легче, чем торий.
Хлориды трёхвалентных актиноидов кристаллизуются в гексагональную сингонию.
- *An — актиноид(-ы)
| Фториды актиноидов | ||||||
|---|---|---|---|---|---|---|
| Соединение | Цвет | Сингония, структурный тип | Параметры ячейки, Å | Плотность, г/см³ | ||
| a | b | c | ||||
| AcF3 | Белый | Гексагональная, LaF3 | 4,27 | — | 7,53 | 7,88 |
| PaF4 | Тёмно-коричневый | Моноклинная | 12,7 | 10,7 | 8,42 | — |
| PaF5 | Чёрный | Тетрагональная, β-UF5 | 11,53 | — | 5,19 | — |
| ThF4 | Бесцветный | Моноклинная | 13 | 10,99 | 8,58 | 5,71 |
| UF3 | Красновато-фиолетовый | Гексагональная | 7,18 | — | 7,34 | 8,54 |
| UF4 | Зелёный | Моноклинная | 11,27 | 10,75 | 8,40 | 6,72 |
| α-UF5 | Голубоватый | Тетрагональная | 6,52 | — | 4,47 | 5,81 |
| β-UF5 | Голубоватый | Тетрагональная | 11,47 | — | 5,20 | 6,45 |
| UF6 | Желтоватый | Орторомбическая | 9,92 | 8,95 | 5,19 | 5,06 |
| NpF3 | Чёрный или пурпурный | Гексагональная | 7,129 | — | 7,288 | 9,12 |
| NpF4 | Светло-зелёный | Моноклинная | 12,67 | 10,62 | 8,41 | 6,8 |
| NpF6 | Оранжевый | Орторомбическая | 9,91 | 8,97 | 5,21 | 5 |
| PuF3 | Фиолетово-синий | Тригональная | 7,09 | — | 7,25 | 9,32 |
| PuF4 | Бледно-коричневый | Моноклинная | 12,59 | 10,57 | 8,28 | 6,96 |
| PuF6 | Красновато-коричневый | Орторомбическая | 9,95 | 9,02 | 3,26 | 4,86 |
| AmF3 | Розовый или светло-бежевый | Гексагональная, LaF3 | 7,04 | — | 7,255 | 9,53 |
| AmF4 | Оранжево-красный | Моноклинная | 12,53 | 10,51 | 8,20 | — |
| CmF3 | От шоколадно-коричневого до блестящего белого | Гексагональная | 4,041 | — | 7,179 | 9,7 |
| CmF4 | Жёлтый | Моноклинная, UF4 | 12,51 | 10,51 | 8,20 | — |
| BkF3 | Жёлто-зелёный | Тригональная, LaF3 Орторомбическая, YF3 |
6,97 6,7 |
— 7,09 |
7,14 4,41 |
10,15 9,7 |
| BkF4 | — | Моноклинная, UF4 | 12,47 | 10,58 | 8,17 | — |
| CfF3 | — — |
Тригональная, LaF3 Орторомбическая, YF3 |
6,94 6,65 |
— 7,04 |
7,10 4,39 |
— |
| CfF4 | — — |
Моноклинная, UF4 Моноклинная, UF4 |
1,242 1,233 |
1,047 1,040 |
8,126 8,113 |
— |
Соли актиноидов легко получаются при растворении соответствующих гидроксидов в кислотах. В свою очередь, нитраты, хлориды, перхлораты и сульфаты актиноидов могут растворяться в воде. Из водных растворов эти соли кристаллизуются, образуя гидраты, например:
- Th(NO3)4·6H2O,
- Th(SO4)2·9H2O,
- Pu2(SO4)3·7H2O.
Ещё одним свойством этих соединений является способность солей актиноидов высшей валентности к легкому гидролизу. Так, бесцветные средние сульфат, хлорид, перхлорат, нитрат тория в растворе быстро переходят в осно́вные соли с химическими формулами Th(OH)2SO4, Th(OH)3NO3.
Своей растворимостью соли трёхвалентных и четырёхвалентных актиноидов подобны солям лантаноидов. Как и для лантана и его аналогов, плохо растворяются в воде фосфаты, фториды, оксалаты, иодаты, карбонаты актиноидов. В этом случае почти все плохорастворимые соли осаждаются в растворе в виде кристаллогидратов, например, ThF4·3H2O, Th(CrO4)2·3H2O.
Актиноиды со степенью окисления +6, кроме катионных комплексов типа MO22+, создают анионы [MO4]2−, [M2O7]2− и некоторые более сложные соединения. Например, у урана, нептуния и плутония известны соли типа уранатов (Na2UO4) и дитиуранатов ((NH4)2U2O7).
По сравнению с лантаноидами, Актиноиды лучше создают координационные соединения. Способность к образованию комплексных соединений у актиноидов увеличивается с увеличением валентности металла. Трёхвалентные Актиноиды не образуют фторидных координационных соединений, в то время как четырёхвалентный торий образует соли типа K2ThF6, KThF5 и даже K5ThF9. Для данного металла легко можно получить соответствующие сульфаты, например Na2SO4·Th(SO4)2·5H2O, нитраты, тиоцианаты. Соли с общей формулой M2Th(NO3)6·nH2O имеют координационную природу, в них у тория координационное число равно 12. Ещё легче комплексные соли создают пятивалентные и шестивалентные Актиноиды. Достаточно стойкие комплексы образуют торий и уран с роданид-ионами. Эти комплексы имеют повышенную стойкость в неводных растворителях.
Также стоит отметить, что наиболее устойчивые координационные соединения актиноидов — четырёхвалентные торий и уран — получаются при реакции с дикетонами, например с ацетилацетоном.
Применение
Большинство актиноидов, до америция включительно, нашли применение в различных областях науки и техники, например приборостроении (датчики дыма), космических технологиях. Однако наиболее массовым и значимым является применение актиноидов для создания ядерного оружия и применение в качестве топлива в ядерных реакторах, в обоих случаях используется свойство некоторых из актиноидов выделять колоссальную энергию при ядерной реакции — делении ядра, которая при определённых условиях может быть цепной, то есть самоподдерживающейся.
Для атомной энергетики очень важным является уран, особенно его изотоп — уран-235, применяющийся в наиболее распространённых реакторах на тепловых нейтронах, содержание которого в природном уране не превышает 0,72 %. Этот изотоп имеет высокое поперечное сечение захвата тепловых нейтронов, поглощая которые 235U делится с выделением большого количества энергии. Превращающаяся в тепло энергия на один акт деления (200 МэВ), в перерасчёте на 1 г прореагировавшего 235U, даёт примерно 1 МВт·сут. Очень ценным является сопровождение деление урана-235 выделением бо́льшего числа нейтронов, чем их затрачивается. При достижении критической массы урана-235 — 0,8 кг — происходит самоподдерживающаяся цепная ядерная реакция. Как правило, ядро урана делится на 2 осколка с высвобождением 2—3 нейтронов, например:
- 235U + 1
0n ⟶ 115Rh + 118Ag + 31
0n
Также перспективным в ядерной энергетике является использование ядерного цикла, основанного на применении тория-232 и полезного продукта, образующегося при его делении — урана-233. Выделение нейтронов при вынужденном делении урана важно не только для поддержания цепной ядерной реакции и получения большого количества энергии, но и для синтеза более тяжёлых актиноидов. Уран-239 распадается посредством β-распада и образует плутоний-239, который подобно урану-235 способен к спонтанному делению. Первые в мире ядерные реакторы предназначались не для мирных нужд энергетики, а для наработки плутония-239, с целью использования его для создания ядерного оружия.
| Ядерный реактор |
|---|
| Основой любого ядерного реактора является активная зона, набранная из тепловыделяющих сборок, которые в свою очередь состоят из тепловыделяющих элементов — металлических стержней, в которых внутри оболочки, обычно выполненной из сплавов циркония, находится ядерное топливо — чаще всего в виде диоксида урана. Также ядерное топливо может использоваться в виде карбидов, нитридов и моносульфидов урана, а также в виде различных соединений плутония, урана и тория (так называемое MOX-топливо).
Для замедления быстрых нейтронов в реакторах на тепловых нейтронах используют замедлители, которые содержат углерод, дейтерий, бериллий. Самым простым и широко используемым замедлителем является Вода. Тепловые нейтроны, получаемые таким образом, взаимодействуют с ядрами урана-235 на несколько порядков чаще, чем с быстрыми. Для регулирования скорости деления ядер в реактор вводят поглотители — специальные стержни, выполненные из бора, кадмия и/или используют жидкий поглотитель, чаще всего в виде раствора борной кислоты, концентрацией которого регулируют реактивность реактора. Реакторы для производства плутония конструируют специально, они отличаются по принципу действия (работают в основном на быстрых нейтронах) и называются реакторами-размножителями или бридерами (от англ. breed — размножать). Их использование позволяет нарабатывать значительные количества плутония. |
Торий применяется в качестве легирующего компонента сплавов магния с цинком. Магниевые многокомпонентные сплавы с примесью тория из-за лёгкости и прочности, высокой температуры плавления и пластичности широко используются в авиационной промышленности и в производстве снарядов. Металлический торий имеет хорошую способность в электронной эмиссии. Лампы с ториевыми электродами имеют малый начальный потенциал и долго не выходят из строя. Относительное содержание изотопов тория и урана часто применяется для оценки возраста звёзд.
В перспективе изотоп плутоний-238 рассматривается исследователями в качестве автономного источника энергии, поскольку его ядерные превращения сопровождаются выделением большого количества тепла. В теории его применение может распространиться и на костюмы космонавтов и водолазов. Но ввиду его высокой цены (1 г изотопа стоит примерно 1000 долларов) его применение ограничено. Этот изотоп был использован на некоторых спутниках Земли в термобатареях и для дистилляции воды на космических кораблях. На американском космическом корабле «Аполлон-11» был размещён маленький нагреватель, источником энергии которого являлся плутоний-238; он включался при облетании затемнённой части Луны.
Для тех же целей, что и для плутония-238, можно применять кюрий-242. Также некоторые изотопы калифорния имеют способность к спонтанному делению. Поскольку критическая масса калифорния мала, то считается, что в будущем из него можно будет изготовлять заряды для атомных пуль.
Отделение плутония от урана, которое происходит с помощью химических реакций, намного проще, чем разделение изотопов урана, что делает перспективным использование оружейного плутония из боеголовок, отработавших свой срок, в качестве топлива в смешанном с торием и ураном виде, так называемом MOX-топливе.
Актиний-227 применяется для изготовления нейтронных источников. Высокое удельное энерговыделение — 14,5 вт/г, возможность получения значительных количеств термически устойчивых соединений актиния — ценные свойства, открывающие хорошие перспективы для использования в термоэлектрических генераторах длительного действия, которые являются пригодными для космических целей. 228Ac применяется в качестве индикатора радиоактивности при химических исследованиях, так как обладает высокоэнергетическим β-излучением с энергией 2,18 МэВ, которое легко регистрируется. Равновесная смесь изотопов 228Ac—228Ra широко используется в качестве источника интенсивного γ-излучения в промышленности и медицине.
Америций-241, будучи источником мягких γ-лучей, применяется в медицинской диагностике и в приборах контроля толщины стальной ленты и листового стекла. На основе кюрия-242 делают генераторы для питания бортовой аппаратуры космических станций, а калифорний-252 используют в нейтронной радиографии в качестве чрезвычайно мощного источника нейтронов.
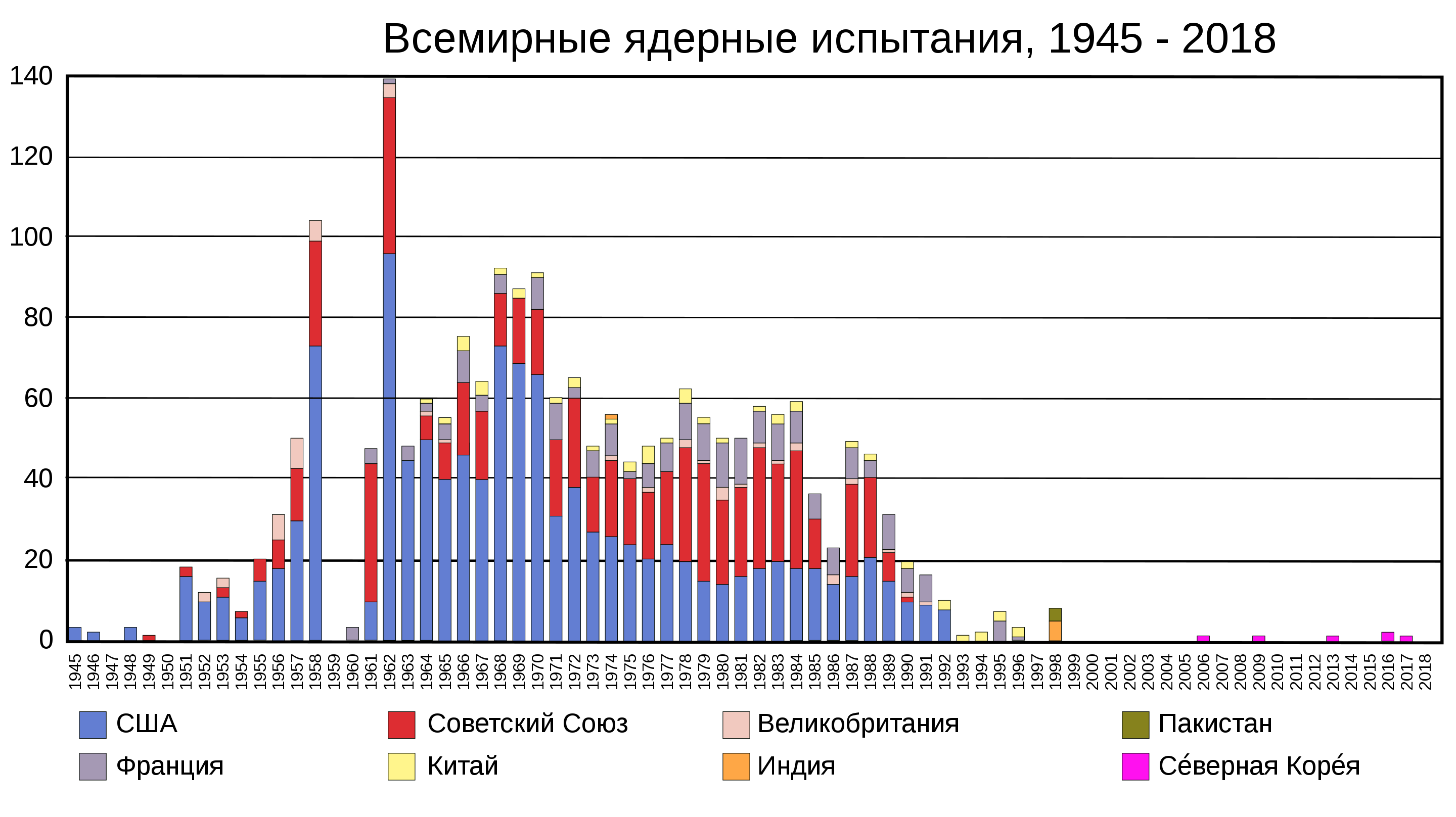
Широкое применение Актиноиды, такие как плутоний, уран, нашли и в ядерном оружии. В XX веке было проведено большое количество испытаний ядерных бомб. К концу XX века массовые испытания ядерного оружия прекратились в связи с улучшением международной обстановки и массовым сокращением количества ядерных вооружений в мире.
Токсичность
Радиоактивные вещества оказывают вредное воздействие на человеческий организм вследствие:
- местного загрязнения кожи, которое было вызвано, например, проливанием или рассыпанием радиоактивного вещества;
- внутреннего облучения вследствие попадания в организм радиоактивных изотопов;
- внешнего чрезмерного облучения наиболее сильными типами — β- и γ-излучением.
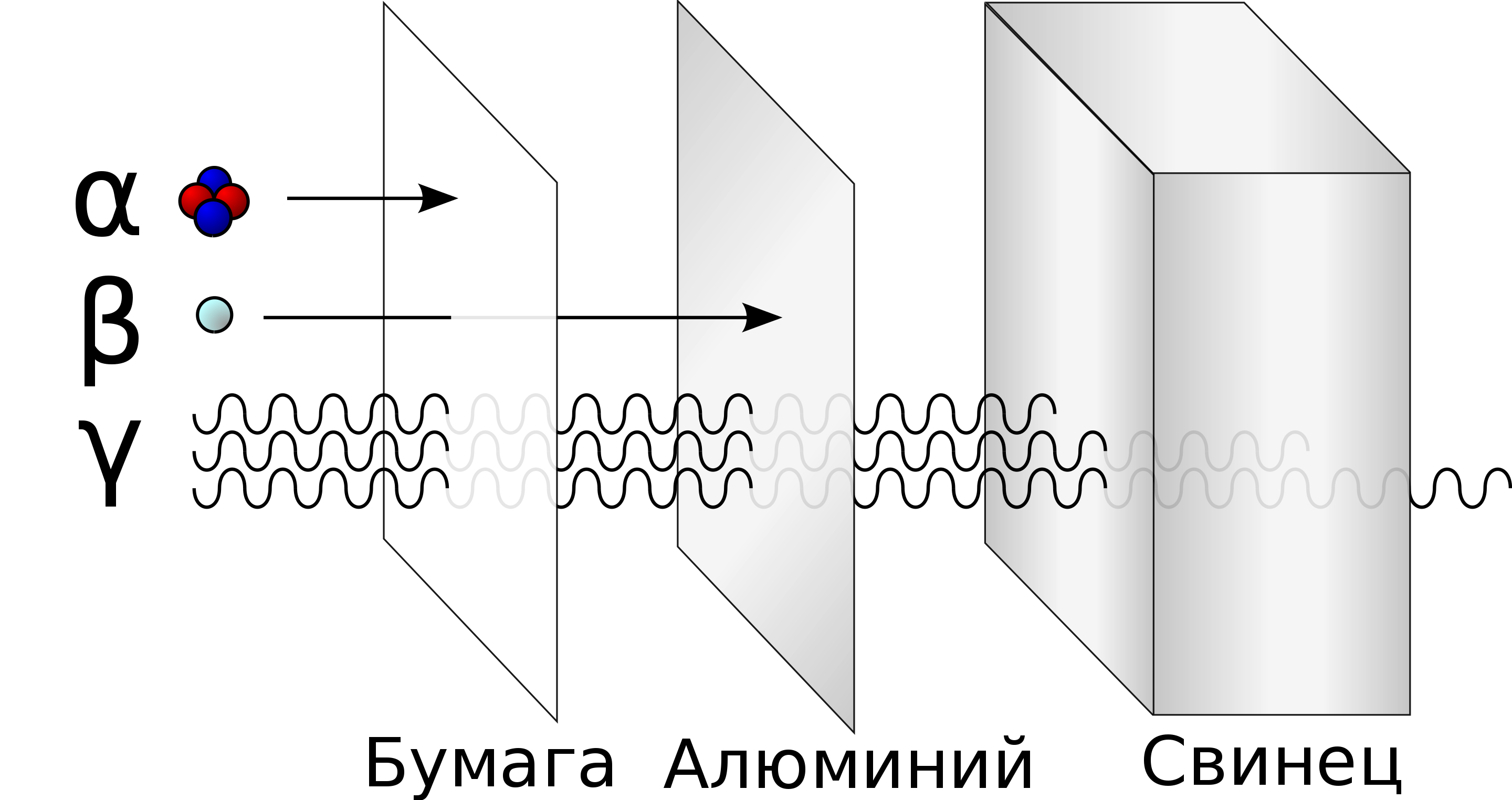
Вместе с радием и трансурановыми элементами актиний относится к числу опасных радиоактивных ядов с высокой удельной α-активностью. Наиболее важной особенностью актиния является его способность к накапливанию и удержанию в скелете в качестве поверхностного слоя. На начальном этапе отравления актинием он накапливается в печени. Ещё одна опасность актиния в том, что он подвергается радиоактивному распаду быстрее, чем выводится из организма. Адсорбция актиния из пищеварительного тракта по сравнению с адсорбцией радия незначительна (>0,05 %). Опасность, связанная с загрязнением кожи и попаданием внутрь, объясняется тем, что в процессе распада актиния образуются газообразные радиоактивные вещества (изотопы радона).
При попадании протактиния в организм он склонен к накоплению в почках и костях. Было установлено, что максимальная безопасная доза протактиния при попадании внутрь организма человека составляет 0,03 мкКи; данная доза соответствует 0,5 мкг 231Pa. Данный изотоп, который содержится в воздухе в виде аэрозолей, в 2,5⋅108 раз токсичнее синильной кислоты (при одинаковых концентрациях).
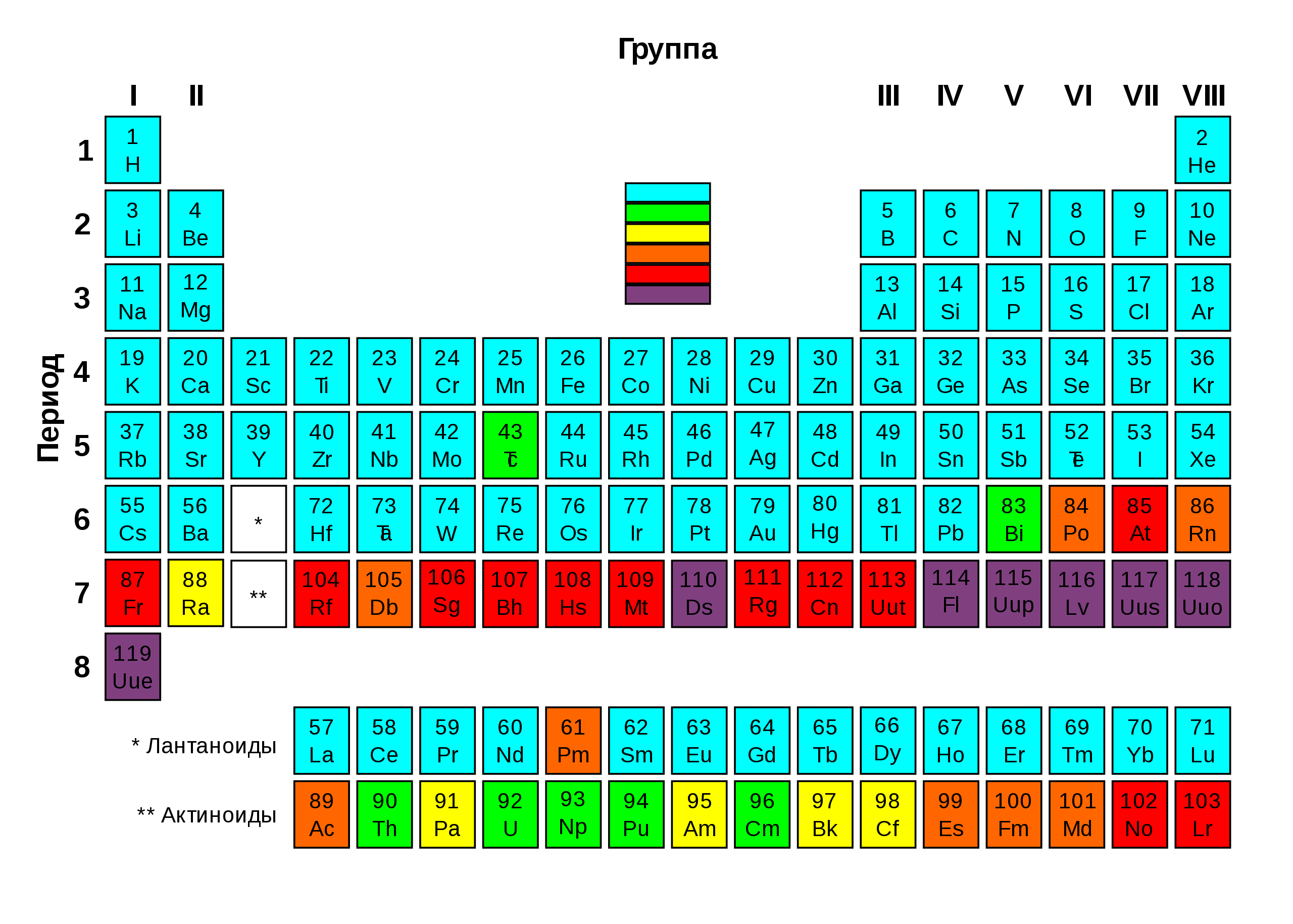
Элементы, содержащие как минимум один стабильный изотоп; Радиоактивные элементы: наиболее стабильный изотоп имеет очень большой период полураспада, более 4 млн лет; Радиоактивные элементы: наиболее стабильный изотоп имеет период полураспада от 800 до 34 000 лет; Радиоактивные элементы: наиболее стабильный изотоп имеет период полураспада от одного дня до 103 лет; Высокорадиоактивные элементы: наиболее стабильный изотоп имеет период полураспада от нескольких минут до одного дня; Экстремально радиоактивные элементы: наиболее стабильный изотоп имеет период полураспада менее нескольких минут. Ввиду их нестабильности и, как следствие, радиоактивности об этих элементах известно очень мало.
Плутоний при поступлении с воздухом, пищей или в кровь через рану оседает в лёгких, печени и костях. Лишь примерно 10 % попадает в другие органы. Атомы плутония задерживаются в организме десятилетиями. Это объясняется биохимическими свойствами плутония и тем, что у изотопов плутония большие периоды полураспада. Отчасти долгое выведение плутония из организма объясняется плохой растворимостью в воде. Все изотопы плутония имеют высокую радиотоксичность, в частности, вследствие того, что часть ядер плутония испускает ионизирующее α-излучение, которое повреждает окружающие клетки. Радиотоксичность находится в обратном отношении с периодом полураспада данного изотопа плутония. Исследования на животных показали, что летальной дозой плутония-244 (наименее радиотоксичного, период полураспада 80 млн лет) является несколько миллиграмм на килограмм ткани. ЛД50 в течение 30 дней для собак после внутривенного введения плутония-244 составляет примерно 0,32 миллиграмма на 1 кг ткани. На основании этих исследований была получена примерная оценка летальной дозы для человека весом 70 кг — 22 мг. При поступлении через органы дыхания поглощение должно быть примерно в 4 раза больше. Этот долгоживущий изотоп плутония проявляет в основном химическую токсичность, подобно нерадиоактивным тяжёлым металлам. Робертом Стоуном, были сделаны расчёты безопасной дозы более короткоживущих изотопов плутония в человеческом организме. Плутоний-239 (период полураспада 24 тыс. лет) в 50 раз менее токсичен, чем радий, и поэтому допустимое содержание плутония-239 в организме, по его расчётам, должно составлять 5 мкг, или 0,3 мкКи. Примечательно, что такое количество плутония трудно рассмотреть даже в современном микроскопе. Вскоре, после испытаний таких доз на животных, данная доза была уменьшена в 5 раз и стала составлять 1 мкг, или 0,06 мкКи. Однако и эта доза была уменьшена, и стала составлять 0,65 мкг, или 0,04 мкКи.
Также были проведены исследования путей попадания плутония в организм человека. В ходе данных исследований было установлено следующее:
- поступление плутония через органы дыхания — наиболее вероятный (и поэтому наиболее опасный) путь. В данном случае в организме удерживается примерно от 5 до 25 % вдыхаемого вещества. В зависимости от размера частиц и растворимости поглощаемых соединений плутония, поступающий плутоний локализуется в лёгких или в лимфатической системе, либо подвергается поглощению в кровь и переносится затем в печень или кости;
- поступление плутония через пищу — наименее вероятный способ. В этом случае в кровь поступает лишь примерно 0,05 % растворимых соединений плутония и только 0,01 % нерастворимых. Остальная часть проходит далее по желудочно-кишечному тракту и выводится из организма;
- при попадании плутония или его соединений в порезы на коже в организме будет удержано до 100 % внесенного вещества.


























