Трихлорид бора
Трихлорид бора
Трихлорид бора — бинарное неорганическое соединение бора и хлора с формулой BCl3. Это бесцветный газ.
Содержание
Физические свойства
При стандартных условиях трихлорид бора BCl3 представляет собой ядовитый, тяжёлый бесцветный газ, вследствие взаимодействия с парами воды дымящийся во влажном воздухе.
При нормальных условиях — это жидкость, давление пара которой описывается уравнением:
- p(mmHg) = 2115T−1 − 7.04lg T + 27.56
В Твёрдом состоянии трихлорид бора образует кристаллы гексагональной сингонии, пространственная группа P63, a =0,6140 нм, c = 0,6603 нм, Z = 9.
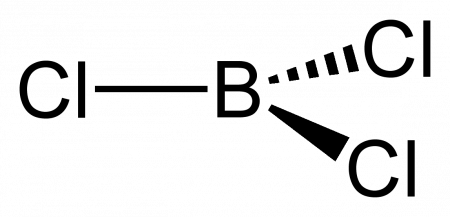
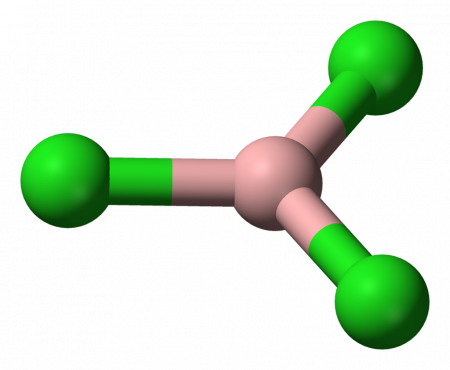
Молекула трихлорида бора представляет собой правильный треугольник (как и другие тригалогениды бора) с длиной связи B—Cl 0,175 нм. Вследствие тригональной симметрии молекула имеет нулевой дипольный момент.
Трихлорид бора не образует димеры, хотя есть косвенные свидетельства того, что он может образовывать димеры при очень низких температурах (20 К).
Получение
Трихлорид бора можно синтезировать из элементов:
- 2 B + 3 Cl2 →>400oC 2 BCl3
В промышленности вместо чистого бора используют его сплавы, например ферробор.
Также в промышленности используют метод хлорирования при температуре ~1000 °C смеси оксида бора и кокса:
- B2O3 + 3 C + 3 Cl2 →1000oC 2 BCl3 + 3 CO
В России используется промышленный метод хлорирования карбида бора при температуре 900—1000 °C:
- B4C + 6 Cl2 →1000oC 4 BCl3 + C
Трихлорид алюминия и трифторид бора могут обмениваться галогенами:
- AlCl3 + BF3 →T BCl3 + AlF3
В лабораторной практике трихлорид бора получают разложением его аддуктов, например, BCl3S(CH3)2, которые удобны в работе, так как являются твёрдыми веществами:
- (CH3)2SBCl3 ⇄ (CH3)2S + BCl3
Химические свойства
Полностью гидролизуется водой с выделением большого количества тепла:
- BCl3 + 3 H2O → B(OH)3 ↓ + 3 HCl
Реагирует с разбавленными и концентрированными щелочами:
Восстанавливается водородом до бора или борана:
- 2 BCl3 + 3 H2 →800−1200oC 2 B + 6 HCl
- 2 BCl3 + 6 H2 →450oC,Cu,Al B2H6 + 6 HCl
Горит в кислороде (на воздухе при температуре >400 °C):
- 4 BCl3 + 3 O2 → 2 B2O3 + 6 Cl2
Фтор вытесняет хлор из соединения:
- 2 BCl3 + 3 F2 → 2 BF3 + 3 Cl2
Трихлорид бора является кислотой Льюиса, которая образует аддукты с третичными аминами, фосфинами, эфирами, тиоэфирами и галогенид-ионами:
- BCl3 + PH3 ⇄ BCl3 ⋅ PH3
Реагирует с оловоорганическими соединениями:
- 2 BCl3 + R4Sn ⟶ 2 RBCl2 + R2SnCl2
При пропускании через трихлорид бора электрической искры получаются низшие хлориды бора B2Cl6, B4Cl4, B8Cl8:
- 2 BCl3 → B2Cl4 + Cl2
Реагирует со спиртами с образованием эфиров-боратов:
- BCl3 + R-OH → B(OR)3 + 3 HCl
При нагревании реагирует с борным ангидридом с образованием оксихлорида бора:
- BCl3 + B2O3 →200oC 3 BOCl
Металлы могут восстанавливать трихлорид бора до бора или образовывать бориды:
- BCl3 + 3 Na →150oC B + 3 NaCl
- 2 BCl3 + 6 Mg → Mg3B2 + 3 MgCl2
Применение
- Треххлористый бор является исходным материалом для производства чистого бора.
- Он также используется в переработке алюминия, магния, цинка и сплавов меди для удаления нитридов, карбидов и оксидов из расплавленного металла.
- Трихлорид бора использовался как флюс для пайки сплавов алюминия, железа, цинка, вольфрама и медно-никелевого сплава.
- Обработка жидкого алюминия парами трихлорида бора улучшает качество отливок.
- Используется при изготовлении электрических сопротивлений для приклеивания углеродной плёнки к керамической основе.
- Используется в плазменном травлении в производстве микроэлектроники
- Используется как реагент в органическом синтезе.
Физиологическое значение
Трихлорид бора BCl3 является потенциально опасным и агрессивным химическим веществом. В больших концентрациях является сильным ирритантом.
Предельно допустимая концентрация трёххлористого бора в воздухе рабочей зоны составляет не более 1 мг/м³.
II класс токсичности согласно ГОСТ 12.1.007-76.