Новости
Нефтегазовая пром.
01.04.2025
01.04.2025
Выставки
Наука и технология
31.03.2025
01.04.2025
31.03.2025
Теги
Тетрафторид кремния
Тетрафторид кремния
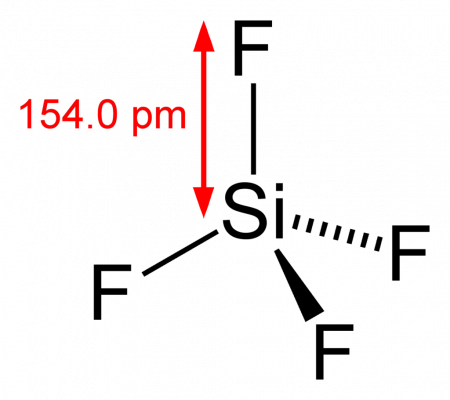
Тетрафторид кремния (тетрафторсилан) — бинарное неорганическое соединение кремния и фтора с формулой SiF4, бесцветный ядовитый газ, легко гидролизуется водой, растворяется в органических растворителях.
Содержание
Получение
- Сгорание кремния в атмосфере фтора:
-
- Si + 2 F2 → SiF4
- Действие фтора на оксид кремния:
-
- SiO2 + 2 F2 →250−400oC SiF4 + O2
- Действие газообразного фтористого водорода на кремний:
-
- Si + 4 HF →40−100oC SiF4 + 2 H2
- или его оксид:
-
- SiO2 + 4 HF →250−400oC SiF4 + 2 H2O
- Разложение кремнефтористоводородной кислоты:
-
- H2[SiF6] →H2SO4 SiF4 ↑ + 2 HF
- или гексафторосиликата натрия:
-
- Na2[SiF6] →600oC SiF4 ↑ + 2 NaF
Физические свойства
Тетрафторид кремния — бесцветный газ, в твёрдом состоянии легко сублимируется, термически устойчив.
В твёрдом состоянии образует кристаллы кубической сингонии, пространственная группа I 43m или I 23, параметры ячейки a = 0,542 нм, Z = 2.
Легко гидролизуется водой, растворяется в органических растворителях.
Химические свойства
- Гидролизуется водой, продукты зависят от температуры:
-
- SiF4 + 4 H2O ⇄ H4SiO4 + 4 HF
- 3 SiF4 + 2 H2O →100oC SiO2 ↓ + 2 H2[SiF6]
- SiF4 + 2 H2O →>100oC SiO2 + 4 HF
- Растворяется в плавиковой кислоте с образованием кремнефтористоводородной кислоты:
-
- SiF4 + 2 HF ⇄ H2[SiF6]
- а при сплавлении с фторидами щелочных металлов образует соли кремнефтористоводородной кислоты:
-
- SiF4 + 2 NaF →200oC Na2[SiF6]
- При нагревании активные металлы вытесняют кремний:
-
- SiF4 + 2 Mg →500oC Si + 2 MgF2
- Реагирует с кремнием:
-
- SiF4 + Si ⇄ 2 SiF2
Применение и токсичность
- Получение кремнефтористоводородной кислоты.
- Очистка кремния и его травление.
- Токсичен, ПДК 0,5 мг/м³.