Оксид бора
Оксид бора
Оксид бора (сесквиоксид бора, борный ангидрид) B2O3 — бинарное неорганическое химическое соединение бора с кислородом, ангидрид борной кислоты, бесцветное, довольно тугоплавкое, стекловидное или кристаллическое вещество, диэлектрик.
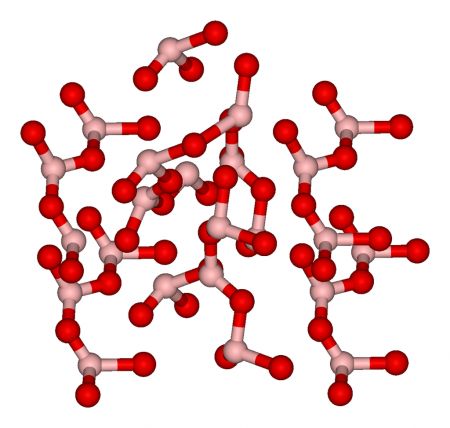
Стеклообразный оксид бора имеет слоистую структуру (расстояние между слоями 0,185 нм), в слоях атомы бора расположены внутри равносторонних треугольников BO3 (d В—О=0,145 нм). Эта модификация плавится в интервале температур 325—450 °C и обладает высокой твёрдостью. Она получается при нагревании бора на воздухе 700 °C или обезвоживанием ортоборной кислоты.
Кристаллический B2O3, который получают осторожным отщеплением воды от метаборной кислоты HBO2, существует в двух модификациях — с гексагональной кристаллической решёткой, при 400 °C и 2200 МПа переходящей в моноклинную.
Содержание
- 1 Свойства
- 2 Получение
- 3 Применение
- 4 Биологическая роль
- 4.1 Токсикология

Свойства
- Борный ангидрид гигроскопичен, он бурно растворяется в воде, образуя вначале различные метаборные кислоты общей формулы (HBO2)n. Дальнейшее оводнение приводит к образованию ортоборной кислоты H3BO3.
- Расплавленный B2O3 хорошо растворяет оксиды многих элементов. С оксидами металлов образует соли бораты.
- B2O3 является кислотным ангидридом, проявляя также очень слабые признаки амфотерности:
-
- 2 B2O3 + P4O10 → 4 BPO4
- B2O3 + 3 H2O → 2 H3BO3
- С соляной кислотой реагирует при нагревании ( t>100∘C ):
- B2O3 + 6 HCl →t 2 BCl3 + 3 H2O
- Сам оксид бора не восстанавливается углеродом даже при температуре белого каления, однако разлагается, если одновременно ввести в реакцию вещества, способные заместить Кислород (хлор или азот):
-
- B2O3 + 3 C + 3 Cl2 → 2 BCl3 + 3 CO
- При нагревании оксида бора с элементарным бором выше 1000о в парах существуют термически устойчивые линейные молекулы O=B—B=O. При быстром охлаждении паров ниже 300о может быть получен белый твёрдый полимер состава (B2O2)n, не имеющий определённой точки плавления и сильно реакционноспособный. Под давлением в 60 тыс. ат. и температуре 1500о оксид бора взаимодействует с элементарным бором по реакции:
-
- B2O3 + 4 B → 3 B2O
- Этот низший оксид бора имеет графитоподобную слоистую структуру.
Получение
Образуется при нагревании бора в атмосфере кислорода или на воздухе
-
- 4 B + 3 O2 → 2 B2O3
А также при обезвоживании борной кислоты:
-
- 2 H3BO3 → B2O3 + 3 H2O
Применение
- Флюсы для стекла и эмали.
- Исходный материал для синтеза других соединений бора, таких как карбид бора.
- Добавка, используемая в стекловолокне (оптических волокнах).
- Используется в производстве боросиликатного стекла.
- Используется в качестве кислотного катализатора в органическом синтезе.
Биологическая роль
Токсикология
Оксид бора B2O3 (сесквиоксид бора; ангидрид борной кислоты) по степени воздействия на организм человека относится к веществам 3-го класса опасности ("умеренно-опасное" химическое вещество).
Предельно допустимая концентрация оксида бора в воздухе рабочей зоны составляет 5 мг/м3.
Реактив пожаро- и взрывобезопасен.
Вдыхание пыли оксида бора, судя по всему, может вызвать раздражение слизистых оболочек.
В больших концентрациях оксид бора может обладать гонадотропным или гепатотоксическим действием.