Хромовая кислота
Хромовая кислота
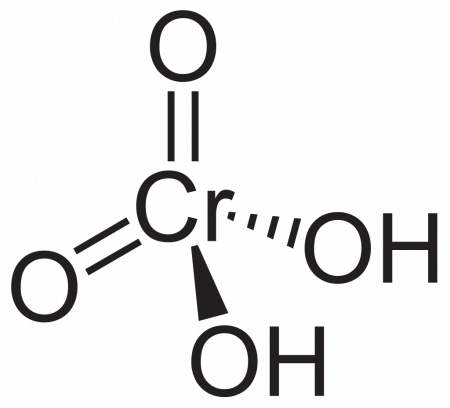
Хромовая кислота — кристаллическое вещество красного цвета. Химическая формула H2CrO4. В водных растворах имеет жёлтый цвет. Выделена в свободном состоянии при охлаждении насыщенных водных растворов хромата.
Соли хромовой кислоты называются хроматами. Сильный окислитель. Токсична, канцерогенна.
Раствор хромовой кислотыСвойства
Химические
Хромовая кислота — электролит средней силы. Изополихромовые кислоты существуют в водных растворах, окрашенных в красный цвет. Соли хромовой кислоты являются сильными окислителями, ядовиты. В хромовой кислоте степень окисления хрома равна +6. Хром, как и большинство переходных металлов, может существовать в нескольких степенях окисления. Степень окисления +6 самая высокая для хрома; степень окисления +3 является наиболее стабильной, степень окисления +2 также. Реагирует с основными оксидами и гидроксидами натрия и калия, например амфотерные оксиды и гидроксид цинка с гидроксидом алюминия в её присутствии или в реакции с хромовой кислотой поведут себя как слабые основания. Продукты реакции — Вода и хроматы металлов. Хромовой кислоте соответствуют соли — хроматы, изополихромовым кислотам — изополихроматы (также дихроматы, изополисоединения).
Получение
- CrO3 + H2O ⟶ H2CrO4
- 3 CrF4 + 10 H2O ⟶ 2 Cr(OH)3 ↓ + H2CrO4 + 12 HF ↑ При кипячении
- 3 CrF5 + 11 H2O ⟶ Cr(OH)3 ↓ + 2 H2CrO4 + 15 HF
Применение
Растворы хромовой кислоты используют при электролитическом хромировании и получении хрома электролизом. Хромовая кислота является промежуточным веществом при хромировании, а также используется в керамической мураве и в цветных композициях стекла. Поскольку раствор хромовой кислоты в серной (также известная как «сульфохромовая кислота») является мощным окислителем, эта смесь может быть использована для очистки лабораторной посуды, или для растворения нерастворимых органических остатков.
Также растворы хромовой кислоты являются качественным реактивом на серебро, наносится тонким слоем на металл. В случае, если изделие сделано из серебра, на нём в месте контакта с реактивом возникает кроваво-красное пятно. Чем чище серебро, тем интенсивнее окраска.
Хромовую кислоту используют для производства:
- металлического хрома высокой чистоты,
- катализаторов,
- электролитического хрома,
- сверхтвердых материалов,
- в производстве литья в составе формовочных и стержневых смесей,
- для процессов хромирования, хроматирования и пассивирования,
- для процессов травления.
Безопасность
Хромовая кислота очень ядовита и канцерогенна, как и все соединения шестивалентного хрома. Как и все кислоты, обладает ещё и коррозионным действием.
Смертельная доза (ЛД50) составляет 51 мг/кг.
В России все соединения шестивалентного хрома относятся к 1 классу опасности.