Новости
Нефтегазовая пром.
04.04.2025
Выставки
Наука и технология
Теги
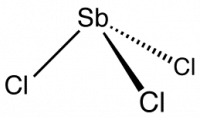
Хлорид сурьмы III
Хлорид сурьмы III
Хлорид сурьмы III — бинарное неорганическое соединение сурьмы и хлора с формулой SbCl3, бесцветные кристаллы, очень хорошо растворимые в холодной воде.
Получение
- Действие хлора на металлическую сурьму:
-
- 2 Sb + 3 Cl2 → 2 SbCl3
- Действием хлористого водорода на триоксид сурьмы:
-
- Sb2O3 + 6 HCl →60−80oC 2 SbCl3 + 3 H2O
- Действием хлора на триоксид сурьмы:
-
- 2 Sb2O3 + 6 Cl2 →1000oC 4 SbCl3 + 3 O2
- Действием хлора на сульфид сурьмы:
-
- 2 Sb2S3 + 9 Cl2 →250oC 4 SSbCl3 + 3 S2Cl2
Физические свойства
Хлорид сурьмы III образует бесцветные гигроскопичные диамагнитные кристаллы. Вызывает ожоги на коже. Очень хорошо растворимые в воде. Концентрированные водные растворы устойчивы и называются «сурьмяное масло» (едкая, жгучая, ядовитая жидкость). Разбавленные водные растворы подвергаются гидролизу.
Растворяется в хлороформе, четырёххлористом углероде, бензоле, диоксане и других органических растворителях.
Химические свойства
- Разлагается в разбавленных растворах или в горячей воде:
-
- SbCl3 + H2O → SbOCl ↓ + 2 HCl
- В подкисленных растворах при нагревании реакция идёт иначе:
- Реагирует с соляной кислотой по-разному, в зависимости от её концентрации:
- Окисляется концентрированной азотной кислотой:
-
- 2 SbCl3 + 4 HNO3 →100oC Sb2O5 ↓ + 6 HCl + 4 NO2
- Реагирует с разбавленными щелочами:
- и концентрированными:
- Хлором окисляется до пентахлорида сурьмы:
-
- SbCl3 + Cl2 →80oC SbCl5
- Реагирует с сероводородом в кислой среде:
-
- 2 SbCl3 + 3 H2S →HF Sb2S3 ↓ + 6 HCl
- С хлоридами щелочных металлов образует комплексные соли:
-
- SbCl3 + 2 KCl → K2[SbCl5]
- Восстанавливается металлами в кислой среде:
-
- 2 SbCl3 + 3 Fe →H+ 2 Sb + 3 FeCl2
Применение
- Для получения чистой сурьмы.
- Катализатор в органическом синтезе.
- Протрава при крашении тканей.
- Как неводный растворитель.