Фосфин
Фосфин
Фосфин (фосфористый водород, фосфид водорода, гидрид фосфора, по номенклатуре IUPAC — фосфан) PH3 — бесцветный ядовитый газ (при нормальных условиях). Чистый фосфин не имеет запаха, но образцы технического продукта обладают неприятным запахом, похожим на запах тухлой рыбы (чеснока).
Содержание
Физические свойства
Бесцветный газ. Плохо растворяется в воде, образует с ней неустойчивый гидрат, который проявляет очень слабые основные свойства. При низких температурах образует твёрдый клатрат 8 PH3·46 H2O. Растворим в бензоле, диэтиловом эфире, сероуглероде. При −133,8 °C образует кристаллы с гранецентрированной кубической решёткой.
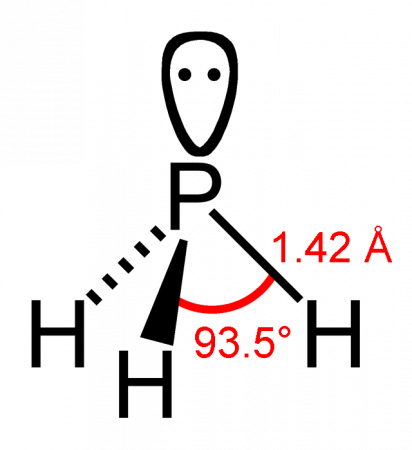
Молекула фосфина имеет форму тригональной пирамиды c молекулярной симметрией C3v (dPH = 0,142 нм, ∠HPH = 93,5°). Дипольный момент составляет 0,58 Д, существенно ниже, чем у аммиака. Водородная связь между молекулами PH3 практически не проявляется и поэтому по сравнению с аммиаком, фосфин имеет более низкие температуры плавления и кипения.
Получение
Фосфин получают при взаимодействии белого фосфора с горячей щёлочью, например:
Также его можно получить воздействием воды или кислот на фосфиды:
- Ca3P2 + 6 H2O → 2 PH3 ↑ + 3 Ca(OH)2
- Mg3P2 + 6 HCl → 2 PH3 ↑ + 3 MgCl2
Хлористый водород при нагревании взаимодействует с белым фосфором:
- P4 + 6 HCl →300∘C 2 PH3 + 2 PCl3
Разложение йодида фосфония:
Разложение фосфоновой кислоты:
- 4 H2(PHO3) →170−200∘C PH3 ↑ + 3 H3PO4
или её восстановление:
- H3PO3 + 3 Zn + 6 HCl → PH3 ↑ + 3 ZnCl2 + 3 H2O
Химические свойства
Фосфин сильно отличается от своего аналога, аммиака. Его химическая активность выше, он плохо растворим в воде, как основание значительно слабее. Последнее объясняется тем, что связи H−P поляризованы слабо и активность неподелённой пары электронов у фосфора (3s2) ниже, чем у азота (2s2) в аммиаке.
В отсутствие кислорода при нагревании разлагается на элементы:
- 2 PH3 →t 2 P + 3 H2
На воздухе горит согласно уравнению:
- PH3 + 2 O2 → H3PO4
Проявляет сильные восстановительные свойства:
- PH3 + 3 H2SO4 → H2(PHO2) + 3 SO2 ↑ + 3 H2O
- PH3 + 8 HNO3 → H3PO4 + 8 NO2 ↑ + 4 H2O
- PH3 + 2 I2 + 2 H2O → H(PH2O2) + 4 HI
В связи с тем, что:
- 4 H2(PHO3) →170−200∘C PH3 ↑ + 3 H3PO4
то возможно протекание следующей реакции:
- PH3 + 4 H2SO4 →200∘C H3PO4 + 4 SO2 ↑ + 4 H2O
При взаимодействии с сильными донорами протонов фосфин может давать соли фосфония, содержащие ион PH4+ (аналогично аммонию). Соли фосфония, бесцветные кристаллические вещества, крайне неустойчивы, легко гидролизуется.
Соли фосфония, как и сам фосфин, являются сильными восстановителями.
Самовозгорание
Абсолютно чистый и сухой фосфин не способен к самовоспламенению на воздухе и загорается только при температуре 100-150°. Однако фосфин, получающийся, например, при взаимодействии фосфидов с водой всегда имеет примесь дифосфина P2H4, который на воздухе самовоспламеняется. В частности, таким образом могут появляться «блуждающие огни».
Токсичность
Фосфин очень ядовит. Поражает в первую очередь нервную систему, нарушает обмен веществ; также действует на кровеносные сосуды, органы дыхания, печень, почки. Запах фосфина ощущается при концентрации 2—4 мг/м³, длительное вдыхание при концентрации 10 мг/м³ может привести к летальному исходу. ПДК — 0,1 мг/м³.
При остром отравлении фосфином в лёгких случаях беспокоит боль в области диафрагмы, чувство холода, впоследствии может развиться бронхит. При среднетяжёлом отравлении — чувство страха, озноб, рвота, стеснение в груди, удушье, боль за грудиной. В тяжёлых случаях на первый план выходят неврологические симптомы — оглушение, неверная походка, подёргивания в конечностях, мидриаз; cмерть от паралича дыхания или сердечной мышцы может наступить через нескольно дней, а при высоких концентрациях — мгновенно.
Хроническое отравление может привести к расстройству зрения, походки, речи, пищеварения, бронхиту, болезням крови и жировому перерождению печени.
Применение
В 2019 году фосфин был предложен в качестве биосигнатурного газа для поиска жизни на землеподобных экзопланетах, поскольку на Земле он производится анаэробными экосистемами. Слабой стороной фосфина для этой цели является его высокая реакционная способность, что требует большой интенсивности производства этого газа для его детектирования. Для его обнаружения в атмосфере экзопланеты потребуются десятки часов наблюдения телескопа «Джеймс Уэбб».